
4.三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2。其反应原理为:
C3N3(OH)3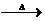 HNCO HNCO+NO2
HNCO HNCO+NO2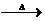 N2+CO2+H2O
N2+CO2+H2O
下列说法中正确的是
A. C3N3(OH)3与HNCO为同一种物质 B. HNCO是一种很强的氧化剂
C. 反应中NO2是还原剂 D .1mol NO2在反应中转移4mol电子
3.下列叙述中,不正确的是
A.目前加碘食盐中,主要添加的是KIO3 B .绿色食品是不含任何化学物质的食品
C .硅材料广泛用于光纤通讯 D .增加植被,保护环境是人类生存的需要
2.物质的量浓度相同时,下列溶液既能与NaOH(aq)反应,又能与盐酸反应且pH值最大的是
A .Na2CO3(aq) B. NH4HCO3(aq) C. NaHCO3(aq) D .NaHSO4(aq)
一、本题包括25小题,每小題2分,共50分。每小题有1个或2个选项符合题意。若该题只有1个选项符合题意,多选或错选均不得分。若该题有2个选项符合题意,选对1个得1分,选对2个得2分;选错1个,该题不得分。
1.空气中含有NOx、CO2、CH4、O3、含氟化合物等等会引起光化学污染、空洞效应、温室效应等破坏环境的作用。下列气体中产生温室效应最大的气体是
A .CO2 B .CH4 C . NOx D. CCl2F2
29.(6分)已知NaCl(s)+H2SO4(浓)NaHSO4+HCl↑,现有117g NaCl和足量的浓硫酸完全反应。求:
(1)产生的HCl在标况时的体积为多少?
(2)将所得HCl气体溶于100g水中,若所得盐酸的密度为1.1 g/mL,则盐酸的物质的量浓度为多少?
28.(10分)实验室要配制100 mL 0.5 mol·L-1的NaCl溶液,试回答下列各题:
(1)下列仪器中,肯定不会用到的是 ( )
A.锥形瓶 B.200 mL容量瓶 C.量筒 D.胶头滴管 E.100 mL容量瓶 F.天平
(2)若要实施配制,除上述仪器外,还缺少的仪器或用品是____________________。
(3)容量瓶上除有刻度线外还应标有_________________,容量瓶在使用前必须进行的一步操作是_________________________。
(4)配制完毕后,老师指出有四位同学各进行了下列某一项错误操作,你认为这四项错误操作会导致所得溶液浓度偏高的是( )
A.定容时仰视容量瓶刻度线 B.定容时俯视容量瓶刻度线
C.将溶解冷却后的溶液直接转入容量瓶后就进行定容操作
D.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处
(5)通过计算可得出可用托盘天平称取NaCl固体________克。若用4 mol/L的NaCl浓溶液配制100 mL 0.5 mol·L-1的稀溶液,应用量筒量取_________mL该浓溶液。
27.(12分)对于混合物的分离或提纯,常采用的方法有:过滤、蒸发、蒸馏、萃取、加热、分解等。下列各组混合物的分离或提纯应采用什么方法?
(1)实验室中的石灰水久置,液面上常悬浮有CaCO3微粒,可用 方法除去Ca(OH)2溶液中悬浮的CaCO3微粒。
(2)除去乙醇中溶解的食盐可采用 的方法。
(3)除去氧化钙中的碳酸钙可用 的方法。
(4)除去镁中的杂质铝所用试剂 ,
反应的离子方程式: 。
26.(8分)
已知0.1 mol/L的NaHSO4溶液中H+的物质的量浓度为0.1mo1/L,请回答下列问题:
(1)写出NaHSO4 在水溶液中电离的方程式 。
(2)NaHSO4属于(填“酸”“碱”或“盐”) 。你的选择理由是
。
(3)若将NaHSO4与Ba (OH)2在溶液中按物质的量之比为2:1混合,化学反应的离子方程式是 。
25.(6分)某待测液中可能含有A13+、Fe3+、K+、NH4+、C1-等离子,现通过如下实验对其中的阳离子进行检验:
(1)取少量待测 液,仔细观察,呈无色;
液,仔细观察,呈无色;
(2)向上述待测液中滴加NaOH溶液,有白色沉淀生成,NaOH溶液过量后沉淀又完全溶解,再加热还有刺激性气味的气体产生,该气体能使湿润的红色石蕊试纸变蓝。
据此可以判断该待测液中一定含有的阳离子是 ,一定没有的阳离子是 。还有一种阳离子没有检验,检验这种离子的实验方法是(填写实验名称) ,现象是 。
二、填空题
24. (12分)某固体化合物A,按下图所示发生系列变化,已知E溶液中加入氨水后产生的白色沉淀很快变为灰绿色,最后变为红褐色。
(12分)某固体化合物A,按下图所示发生系列变化,已知E溶液中加入氨水后产生的白色沉淀很快变为灰绿色,最后变为红褐色。
(1)请写出下列物质的化学式:A 、C 。
(2)在①②③④各步反应中属于氧化还原反应的有 (填序号)。
(3)请 分别写出反应①的化学方程式和反应③的离子方程式:①
、③ 。
分别写出反应①的化学方程式和反应③的离子方程式:①
、③ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com