
7.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
A.电解饱和食盐水时,阳极的电极反应式为:
2Cl--2e-===Cl2↑
B.氢氧燃料电池的负极反应式:
O2+2H2O+4e-===4OH-
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-===Cu2+
D.钢铁发生电化学腐蚀的正极反应式:
Fe-2e-===Fe2+
解析:在氢氧燃料电池的负极上反应的是氢气;粗铜精炼时,纯铜与电源的负极相连,钢铁腐蚀的负极反应是Fe-2e-===Fe2+。
答案:A
6.[双选题](2011·海南高考)根据下图,下列判断中正确的是( )
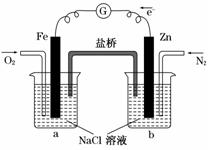
A.烧杯a中的溶液pH升高
B.烧杯b中发生氧化反应
C.烧杯a中发生的反应为2H++2e-===H2
D.烧杯b中发生的反应为2Cl--2e-===Cl2
解析:由图知,烧杯b中的Zn棒失去电子,发生氧化反应,电子转移到Fe棒上,烧杯a中通入的氧气在Fe棒表面得电子生成氢氧根离子,使a中溶液的pH升高。所以正确的为A、B。
答案:AB
5.(2011·衡水模拟)下列说法正确的是( )
A.铅蓄电池放电时铅电极发生还原反应
B.电解饱和食盐水在阳极得到氯气,阴极得到金属钠
C.给铁钉镀铜可采用CuSO4作电镀液
D.生铁浸泡在食盐水中发生析氢腐蚀
解析:铅蓄电池放电时铅电极失去电子发生氧化反应,A错误;电解饱和食盐水,阳极上得到氯气,阴极上得到氢气,B错误;电镀时电镀液采用镀层金属的可溶性盐溶液,C正确;食盐水为中性溶液,所以应发生吸氧腐蚀,D错误。
答案:C
4.为防止钢铁锈蚀,下列防护方法中正确的是( )
A.在精密机床的铁床上安装铜螺钉
B.在排放海水的钢铁阀门上用导线连接一块石墨,一同浸入海水中
C.在海轮舷上用铁丝系住锌板浸在海水里
D.在电动输油管的铸铁管上接直流电源的正极
解析:A、B中形成原电池都是铁作负极,加速铁的腐蚀;D中铸铁管作阳极,加速腐蚀;C中锌比铁活泼,铁作正极,受到保护。
答案:C
3.铜—锌—稀硫酸组成的原电池,放电一段时间后,溶液的pH将( )
A.不变 B.升高
C.降低 D.无法确定
解析:此原电池放电时,反应消耗硫酸,使溶液的酸性降低。
答案:B
2.下列有关电池的说法不正确的是( )
A.手机上用的锂离子电池属于二次电池
B.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极
C.甲醇燃料电池可把化学能转化为电能
D.锌锰干电池中,锌电极是负极
解析:铜锌原电池工作时,电子由负极(锌)沿外电路流向正极(铜),B错误。
答案:B
一、选择题
1.下列装置中,都伴随有能量变化,其中是由化学能转变为电能的是( )
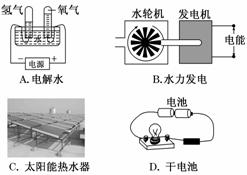
解析:干电池将化学能转化为电能;电解是将电能转化为化学能;水力发电是将势能转化为电能;太阳能热水器是将太阳能转化为热能。
答案:D
38. (10分)某铝合金中含铜、锌、铝和硅。现取1.000g铝合金与足量盐酸反应,生成843mL H2(0℃,101.325 kPa下),未溶物为0.170g。再称取0.500g铝合金与足量NaOH溶液反应,生成517mL H2(0℃,101.325 kPa下),仍有部分固体未溶。计算此合金中各组分的百分含量。(需写出相应的反应方程式,有效数字有一个错,扣掉有效数字分2分)。
2007年全国高中学生化学竞赛(安徽赛区)初赛试题
37. (12分)将甲苯加入到KMnO4和Na2CO3混合溶液中加热反应,反应后加入足量的盐酸,析晶、过滤、洗涤,再提纯后,得到纯的A晶体。
称取0.1221g A,加入50.00mL、0.04000mol·L-1NaOH溶液溶解,再加入20.00mL、0.05000 mol·L-1 HCl溶液,恰好为化学计量点,加水稀释到150.0 mL,称此液为x液。
另称取0.1221g A,加水100.0mL和12.50mL、0.04000mol·L-1 NaOH溶液,搅匀后,测得此溶液的pH值为4.19。
(1)计算A的摩尔质量
(2)计算x溶液的pH值(活度系数为1)
(3)在制备A时,加入盐酸有什么作用?
四、本题包括3小题,共37分
36. (15分)碱金属元素中,只有金属锂与氮气直接化合,生成氮化锂晶体。在该晶体中,存在锂、氮原子共同组成的锂、氮层。其排布方式为锂原子以石墨晶体中的碳原子方式排布,氮原子在锂原子构成的六边形的中心。
(1)试画出锂、氮层的平面晶体结构,从中取出两种不同类型的晶胞;
(2)你认为在锂、氮层之间还应存在什么层?说明理由;
(3)试画出氮化锂晶体的晶胞(分别以氮、锂原子为顶点);
(4)写出(3)晶胞中各原子的分数坐标;
(5)已知氮化锂晶胞中的dLi-N为213pm,层间距为194pm,计算氮化锂晶体密度;
(6)在氮化锂晶体中,存在何种作用力?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com