
4.下列有关物质性质的应用正确的是
A.液氨汽化时要吸收大量的热,可用作制冷剂
B.二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸
C.生石灰能与水反应,可用来干燥氯气
D.氯化铝是一种电解质,可用于电解法制铝
3.常温下,下列各组离子在指定溶液中一定能大量共存的是
A.使甲基橙变红色的溶液:Mg2+、K+、SO42- 、NO3-
B.使酚酞变红色的溶液:Na+、Cu2+、HCO3- 、NO3-
C.0. 1 mol·L-1AgNO3 溶液:H+、K+、SO42- 、I-
D.0. 1 mol·L-1NaAlO2 溶液: H+、Na+、Cl-、SO42-
2.下列有关化学用语表示正确的是
A.丙烯的结构简式:C3H6
B.氢氧根离子的电子式: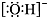
C.氯原子的结构示意图:
D.中子数为146、质子数为92 的铀(U)原子146 92U
1.燃料电池能有效提高能源利用率,具有广泛的应用前景。下列物质均可用作燃料电池的燃料,其中最环保的是
A.甲醇 B.天然气 C.液化石油气 D.氢气
0.004 mol 0.128 g
M==64 g/mol。
答案:(1)正 氧化 (2)阳 氧气 阴 氢气
(3)4OH--4e-===O2↑+2H2O
(4)在开始反应的1~4 min内,由于生成的氧气和氢气在水中的溶解没有达到饱和,氧气的溶解度大于氢气,故氢气和氧气的体积比大于2∶1;随着反应的进行,到4 min后,由于生成的氧气和氢气在水中的溶解均达到饱和,故体积比约等于2∶1 (5)不变 (6)64 g/mol
22.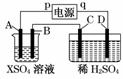 (13分)如右图所示,p、q为直流电源的两极,A由金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D上产生气泡,试回答:
(13分)如右图所示,p、q为直流电源的两极,A由金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D上产生气泡,试回答:
(1)p为________极,A极发生了________反应。
(2)C为________极,可收集到________;D为________极,可收集到________。
(3)C极的电极反应式为________________________________________________。
(4)在电解过程中,测C、D两极上产生气体的体积,实验数据如下表:
|
时间(min) |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
阴极产生气体 的体积(cm3) |
6 |
12 |
20 |
29 |
39 |
49 |
59 |
69 |
79 |
89 |
|
阳极产生气体 的体积(cm3) |
2 |
4 |
7 |
11 |
16 |
21 |
26 |
31 |
36 |
41 |
仔细分析以上实验数据,请说出变化的可能原因是
________________________________________________________________________。
(5)当反应进行一段时间后,A、B电极附近溶液的pH________(填“增大”“减小”或“不变”)。
(6)当电路中通过0.004 mol电子时,B极上沉积的金属X为0.128 g,则此金属的摩尔质量为____________。
解析:(1)B极:X2++2e-===X因此B为阴极,由此可推知A是阳极。C是阳极,D是阴极,p为正极。
(4)从O2和H2在水中的溶解度大小回答。
(5)中A极:X-2e-===X2+,B极:X2++2e-===X,故两极pH不变。
(6)设X的摩尔质量为M,则:
X2++2e-=== X
2 mol M
21.(6分)(2011·重庆高考节选)O3可由臭氧发生器(原理如图)电解稀硫酸制得。
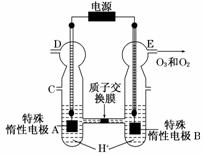
(1)图中阴极为________(填“A”或“B”),其电极反应式为__________________。
(2)若C处通入O2,则A极的电极反应式为________。
(3)若C处不通入O2,D、E处分别收集到x L和y L气体(标准状况),则E处收集的气体中O3所占的体积分数为________(忽略O3的分解)。
解析:观察电化学装置图知,特殊惰性电极B上产生了氧气和臭氧,该极失去电子发生氧化反应作阳极,则特殊惰性电极A为阴极,得电子发生还原反应,电极反应式为2H++2e-===H2↑;若从C处通入氧气,氧气将参与反应,阴极生成的将是水,电极反应为O2+4H++4e-===2H2O;设y L混合气体中臭氧的体积分数为a,由电子守恒有2x=y a×6+y (1-a)×4,解得a=(x-2y)/y。
答案:(1)A 2H++2e-===H2↑
(2)O2+4H++4e-===2H2O
(3)(x-2y)/y
20.(9分)在25 ℃时,用石墨电极电解2.0 L 2.5 mol·L-1CuSO4溶液,如有0.20 mol电子发生转移,请回答下列问题:
(1)阴极发生___________________________________________________________反应,
电极反应式为_____________________________________________________________;
(2)阳极发生___________________________________________________________反应,
电极反应式为________________________________________________________;
(3)电解后得到的铜的质量是________,得到氧气的体积是________(标准状况),溶液的pH是________________________________________________________________________;
(4)如果用等质量的两块铜片代替石墨作电极,电解后两铜片的质量相差________,电解液的pH________________________________________________________________________。
解析:用石墨电极电解CuSO4溶液:
阳极反应式:4OH--4e-===2H2O+O2↑,
阴极反应式:2Cu2++4e-===2Cu。
当线路中有0.20 mol电子转移时,析出铜的质量为
m(Cu)= mol×64 g·mol-1=6.4 g。
产生O2的体积
V(O2)=×22.4 L·mol-1=1.12 L。
c(H+)==0.1 mol/L,pH=-lg 0.1=1。
若用Cu片代替石墨电极,则该装置为电镀池,电解后溶液pH不变。当转移0.2 mol电子时,阳极溶解6.4 g,Cu阴极析出6.4 g Cu,则两极质量差为6.4+6.4=12.8(g)。
答案:(1)还原 2Cu2++4e-===2Cu
(2)氧化 4OH--4e-===2H2O+O2↑
(3)6.4 g 1.12 L 1 (4)12.8 g 不变
19.(8分)某实验小组的同学采用如图所示装置来进行有关化学实验,请填充下列空格。
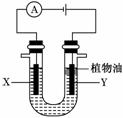
(1)若U形管中盛有硫酸钠溶液,X、Y电极分别为石墨和铁棒,电解过程中出现的现象是________________。
U形管中加入的少量植物油作用是________。
(2)电解一段时间后,某同学将电源反接,此时出现的现象是________________________________________________________________________。
有关的化学方程式为______________________________________________________。
解析:铁作阳极时,铁失电子发生氧化反应,生成二价铁离子:Fe-2e-===Fe2+,阴极发生还原反应:2H++2e-===H2↑。阳极生成的二价铁离子向阴极扩散,而阴极产生的氢氧根离子向阳极扩散,二者在U形管中间相遇结合成氢氧化亚铁白色沉淀。氢氧化亚铁极易被空气中氧气氧化,故U形管中加入少量植物油以隔绝空气。当反接电源时,为电解水,X、Y极分别生成氧气和氢气,氧气将氢氧化亚铁氧化为氢氧化铁。
答案:(1)X极有气泡冒出,Y极附近溶液渐变浅绿色,U形管下部中间位置出现白色沉淀隔绝空气(防止白色沉淀被氧化变质)
(2)X、Y两极都有气泡冒出,且白色沉淀迅速变成灰绿色,最后变成红褐色 2H2O电解2H2↑+O2↑,4Fe(OH)2+O2+2H2O===4Fe(OH)3
18.(7分)(2012·潍坊模拟)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空。如图1所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-离子(O2+4e-―→2O2-)。
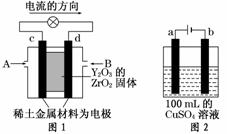
(1)c电极的名称为________,d电极上的电极反应式为
________________________________________________________________________。
(2)如图2所示用惰性电极电解100 mL 0.5 mol·L-1CuSO4溶液,a电极上的电极反应式为________________________________________,若a电极产生56 mL(标准状况)气体,则所得溶液的pH=________(不考虑溶液体积变化),若要使电解质溶液恢复到电解前的状态,可加入________(填序号)。
a.CuO b.Cu(OH)2
c.CuCO3 d.Cu2(OH)2CO3
解析:(1)原电池中电流的方向是从正极流向负极,故c电极为正极;d电极为负极,通入的气体为甲烷,d电极反应式为:CH4+4O2--8e-===CO2+2H2O。
(2)用惰性电极电解CuSO4溶液时,阳极(a电极)反应式:4OH--4e-===2H2O+O2↑;阴极反应式:
2Cu2++4e-===2Cu,
n(O2)==2.5×10-3mol。
线路中转移电子的物质的量为2.5×10-3 mol×4=0.01 mol,溶液中c(H+)==0.1 mol/L,
pH=-lg 0.1=1。加入CuO或CuCO3与溶液中的H+反应,可使电解质溶液恢复到电解前的状态。
答案:(1)正极 CH4+4O2--8e-===CO2↑+2H2O
(2)4OH--4e-===2H2O+O2↑ 1 ac
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com