
13.下列有关物质性质、结构的表述均正确,且存在因果关系的是( )
|
|
表述Ⅰ |
表述Ⅱ |
|
A |
在水中,NaCl的溶解度比I2的溶解度大 |
NaCl晶体中Cl与Na间的作用力大于碘晶体中分子间的作用力 |
|
B |
通常条件下,CH4分子比PbH4分子稳定性高 |
Pb的原子半径比C的大,Pb与H之间的共价键强度比C与H间的小 |
|
C |
在形成化合物时,同一主族元素的化合价相同 |
同一主族元素原子的最外层电子数相同 |
|
D |
P4O10、C6H12O6溶于水后均不导电 |
P4O10、C6H12O6均属于共价化合物 |
解析:选B。A选项中,NaCl溶于水是离子化合物的特性,I2是非极性分子溶解度小;B选项中分子的稳定性与共价键的强度有关,非金属性越强原子间的结合力越强,所以正确;C中形成化合物不一定是最高价或最低价,所以不与最外层电子数呈因果关系;D选项不能因为不导电而认为是共价化合物,如HCl溶于水能导电,且是共价化合物。
12.(2011年宿迁高一调研)锂原子比镁原子少1个电子层,最外层电子数也比镁原子少1,在周期表中锂和镁的位置关系存在有“对角线”关系,“对角线”关系的元素性质存在相似性。下列关于锂的判断可能正确的是( )
A.Li能在空气中燃烧 B.Li2O熔点较低
C.Li2CO3能溶于水
 D.LiOH受热是易分解
D.LiOH受热是易分解
解析:选A。有“对角线”关系的元素性质存在相似性,再结合已知的镁及其化合物的知识,可判断出锂及其化合物可能的性质。
二、不定项选择题
11.下列叙述中,正确的是( )
A.39K+和40Ca2+微粒中的电子数和中子数都相等
B.D2和He在同温同压时,若体积相等,则质量相等
C.同一元素的各种同位素的物理性质、化学性质均相同
D.两个质量数和电子数都相等的微粒一定是同种元素
解析:选AB。39K+和40Ca2+微粒中的电子数相等(19-1=20-2=18),中子数相等(39-19=40-20=20);D2和He的相对分子质量均为4,在同温同压时,若体积相等,则质量相等;同一元素的各种同位素的化学性质均相同,但是物理性质不一定相同;NH3和Ne的质量数和电子数都相等,但是一个是分子,另外一个是原子。
10.如下图所示为各元素周期表中的一部分,表中数字是原子序数,其中X为35的是( )
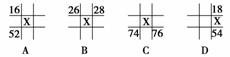
解析:选A。B、D项中同主族上、下周期原子序数相差18;C项中同主族上、下周期原子序数相差32。
9.元素A和B的原子序数都小于18。已知A元素原子的最外层电子数为a,次外层电子数为b;B元素原子的M层电子数为(a-b),L层电子数为(a+b),则A、B两元素所形成的化合物的晶体类型为( )
A.分子晶体 B.原子晶体
C.离子晶体 D.金属晶体
解析:选B。根据核外电子排布规律,有a-b>0,a+b=8,原子序数都小于18的元素最多有3个电子层,所以次外层电子数b为2或8,若b=8,则a=0,不符合题意,所以只能是b=2,则a=6。即A元素原子的核外电子排布为 ,为氧元素;B元素原子的核外电子排布为
,为氧元素;B元素原子的核外电子排布为 ,为硅元素,所形成的化合物是SiO2,属于原子晶体。
,为硅元素,所形成的化合物是SiO2,属于原子晶体。
8.下列各表中的数字代表的是原子序数,表中数字所表示的元素与它们在元素周期表中的位置相符的是( )
|
3 |
|
5 |
|
|
12 |
|
|
|
20 |
|
A
|
1 |
|
|
|
|
4 |
5 |
|
|
|
15 |
 B
B
|
1 |
|
2 |
|
11 |
|
|
|
19 |
|
|
C
|
8 |
|
10 |
|
|
17 |
|
|
|
|
36 |
D
解析:选D。A中原子序数为5的元素位置不对;B中原子序数为5和15的元素位置不对,且二者不是同一主族元素;C中原子序数为2的元素位置不对。
7.下列物质对应的电子式书写正确的是( )

6.下列物质呈固态时必定属于分子晶体的是( )
A.非金属氧化物 B.金属氧化物
C.非金属单质 D.常温下呈气态的物质
解析:选D。非金属氧化物如SiO2为原子晶体,A项不正确;金属氧化物一般为离子化合物,B项不正确;非金属单质如金刚石(原子晶体)不是分子晶体,C项不正确;常温下为气态的主要是非金属单质及其氯化物或氢化物,只存在分子并形成分子晶体。
5.(2010年高考全国卷Ⅰ)下列判断错误的是( )
A.沸点:NH3>PH3>AsH3
B.熔点:Si3N4>NaCl>SiI4
C.酸性:HClO4>H2SO4>H3PO4
D.碱性:NaOH>Mg(OH) 2>Al(OH)3
2>Al(OH)3
解析:选A。PH3的相对分子质量大于AsH3的,所以PH3的沸点小于AsH3的,A错误:Si3N4是沸点很高的原子晶体,SiI4是分子晶体,B正确;Cl、S、P非金属性逐渐增强,所以其最高价氧化物对应水化物的酸性也逐渐增强,C正确;Na、Mg、Al的金属性逐渐减弱,所以其最高价氧化物对应水化物的碱性也逐渐减弱,D正确。
4.(2011年无锡高一质检)下列对元素周期表说法不正确的是( )
A.在第ⅥB和第ⅦB族附近可以找到耐高温金属材料
B.第ⅣA族所有含氧酸的钠盐,溶于水均呈碱性
C.如果已知元素的最外层电子数为2,由此不能判断该元素在周期表中的位置
D.目前已知发现的第ⅣA族元素为5种,所以该族元素共有5种单质
解析:选D。熔点最高的金属W位于元素周期表的第ⅥB族,该族附近的原子的价电子数较多,金属键较强,它们的熔沸点普遍很高;第ⅣA族的元素非金属性较弱,形成的含氧酸均为弱酸,故其钠盐为强碱弱酸盐,水解呈碱性;最外层电子数为2的元素很多,如过渡金属元素、第ⅡA族元素、He等;第ⅣA族元素中C就有多种单质,如金刚石、石墨、球碳分子等。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com