
7.解析:a、b不连接,未形成原电池,Cu2+与Fe在接触面上直接反应,A项正确;a、b用导线连接,铜片作正极,Cu2+在该电极上得电子,B项正确;a、b连接与否,溶液中的Cu2+均得电子发生还原反应生成Cu,Fe均失电子发生氧化反应生成Fe2+,故溶液均从蓝色逐渐变成浅绿色,C项正确;a与电源正极相连时,Cu片作阳极,Cu2+向Fe电极移动,D项错误。
答案:D
6.解析:A项,负极发生氧化反应,不正确;B项,该电池中MnO2发生还原反应,不是催化剂,不正确;C项,电池工作时电流由正极(MnO2)经导线流向负极(Zn),故不正确;D项,正极发生还原反应,正确。
答案:D
5.解析:由图可知,该电池反应为:Zn+H2SO4===ZnSO4+H2↑,活泼金属Zn作负极,Cu作正极;外电路中电流由正极流向负极,①、④、⑤错误;Zn失去电子被氧化成Zn2+,失去的电子经外电路流向正极,溶液中的H+在正极上得到电子,析出H2,②、③、⑥正确。
答案:D
4.解析:铁片、锌片、Fe2(SO4)3溶液组成的原电池中锌片为负极,铁片为正极,原电池反应为Zn+2Fe3+===2Fe2++Zn2+。
答案:C
3.

2.解析:根据图示,光伏电池是将太阳能直接转变为电能的装置,A正确,B错误。外电路中,电流从b流向a,C错误。由于电流从P型半导体流出,因而P型半导体为正极,D错误。
答案:A
1.解析:A项两个电极均选择Cu,不能形成原电池;C项没有形成闭合回路;D项酒精为非电解质,不能导电。
答案:B
15.(12分)甲烷作为一种新能 源在化学领域应用广泛,请回答下列问题:
源在化学领域应用广泛,请回答下列问题:
(1)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH=260 kJ·mol-1
已知:2CO(g)+O2(g)===2CO2(g)
ΔH=-566 kJ·mol-1
则CH4与O2反应生成CO和H2的热化学方程式为:_______________________________________。
(2)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。

①a处应通入______(填“CH4”或“O2”),b处电极上发生的电极反应式是_____________________________________________________________;
②电镀结束后,装置Ⅰ中溶液的pH______(填写“变大”“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度______;
③电镀结束后,装置Ⅰ溶液中的阴离子除了OH-以外还含有______________(忽略水解);
④在此过程中若完全反应,装置Ⅱ中阴极质量变化12.8 g,则装置Ⅰ中理论上消耗甲烷________L(标准状况下)。
答案详解
14.(10分)有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均使用镁片与铝片作电极,但甲同学将电极放入6 mol/L H2SO4溶液中,乙同学将电极放入6 mol/L的NaOH溶液中,如图所示。
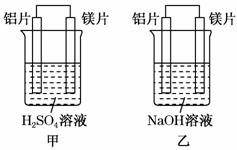
请回答:
(1)写出甲池中正极的电极反应式:__________________________________________________。
(2)写出乙池中负极的电极反应式和总反应的离子方程式:负极__________________________,总反应的离子方程式为_________________________________________________。
(3)如果甲、乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出______活动性更强,而乙会判断出______活动性更强(填写元素符号)。
(4)由此实验,可得到如下哪些正确结论?_______________________________(填写字母序号)。
a.利用原电池反应判断金属活动性顺序时应注 意选择合适的介质
意选择合适的介质
b.镁的金属性不一定比铝的金属性强
c.该实验说明金属活动性顺序已过时,已没有实用价值
d.该实验说明化学研究对象复杂,反应受条件影响较大,因此应具体问题具体分析
(5)上述实验也反过来证明了“直接利用金属活动性顺序判断原电池中的正负极”这种做法___________ (填“可靠”或“不可靠”)。
13.(10分)依据氧化还原反应Zn(s)+Cu2+(aq)===Zn2+(aq)+Cu(s)设计的原电池如图所示。

请回答下列问题:
(1)电极X的材料是____________;电解质溶液Y是__________________。
(2)铜电极为电池的________极,发生的电极反应为______________________________,X极上发生的电极反应为____________________________________________。
(3)外电路中的电子是从________极流向_______ _极。
_极。
(4)盐桥中的Cl-向________极移动,如将盐桥撤掉,电流计的指针将________偏转。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com