
64.(6分)将含有C、H、O的有机物3.24 g装入元素分析装置,通入足量的O2使之完全燃烧,将生成的气体依次通过装有浓硫酸的洗气瓶和碱石灰的干燥管,测得洗气瓶的质量增加了2.16 g,干燥管的质量增加了9.24 g,已知该有机物的相对分子质量为108。
(1)求此有机物的分子式。
(2)已知该物质中含有苯环,且1mol该物质与金属钠反应后生产标准状况下氢气0.5mol,试写出该物质的任一种结构简式。
(3)燃烧此 有机物3.24
g需消耗O2多少g?
有机物3.24
g需消耗O2多少g?
四、计算题
62、(12分)某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素。实验条件作如下限定:所用KMnO4酸性溶液的浓度可选择0.01 mol·L-1、0.001 mol·L-1, 催化剂的用量可选择0.5g、0g,实验温度可选择298K、323K。每次实验KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液(0.1 mol·L-1)的用量均为2mL。
(1)配平化学方程式:
______KMnO4 +____H2C2O4 +_____H2SO4 → ____K2SO4 +_____MnSO4 +_____CO2 +______H2O(4分)
(2)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
|
实验编号 |
T/K |
催化剂的用量/ g |
KMnO4酸性溶液的浓度/mol·L-1 |
实验目的 |
|
① |
298 |
0.5 |
0.01 |
(Ⅰ)实验①和②探究KMnO4酸性溶液的浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和______(1分)探究催化剂对该反应速率的影响 |
|
② |
|
|
|
|
|
③ |
|
|
|
|
|
④ |
|
0 |
|
(3)在完成探究催化剂对该反应速率影响的实验时发现,未加催化剂的情况下,刚开始一段时间,反应速率较慢,溶液褪色不明显,但不久后突然褪色,反应速率明显加快。
针对上述实验现象,同学认为高锰酸钾与草酸溶液的反应放热,导致溶液温度升高,反应速率加快,从影响化学反应速率的因素看,你猜想还可能是________________(1分)
若用实验证明你的猜想。除酸性高锰酸钾溶液,草酸溶液外,还需要选择的试剂最合理的是_______(1分)
A.硫酸钾 B.硫酸锰 C.二氧化锰 D.水
(4)某同学对实验①和②分别进行三次实验,测得以下实验数据(从混合振荡均匀开始计时):
|
KMnO4酸性溶液 的浓度 / mol·L-1 |
溶液褪色所需时间 t / min |
||
|
第1次 |
第2次 |
第3次 |
|
|
0.01 |
14 |
13 |
11 |
|
0.001 |
6 |
7 |
7 |
计算用0.001 mol·L-1 KMnO4酸性溶液进行实验时KMnO4的平均反应速率 (忽略混合前后溶液体积的变化)(2分)。
(5) 若不经过计算,直接看表中的褪色时间长短来判断浓度大小与反应速率的关系是否可行?_________(1分)。若不可行(若认为可行则不填),请设计可以通过直接观察褪色时间长短来判断的改进方案_____________________________________(2分)
61、化学家鲍林在研究含氧酸的强弱时,提出了一个定性规则:含氧酸分子中的非羟基(注:羟基是—OH)氧原子数与酸性强弱成相关性。设含氧酸化学式为HnROm,则非羟基氧原子数为(m-n),其数值越大,该含氧酸的酸性越强。鲍林认为含氧酸的强弱与非羟基氧原子数(m-n)有如下关系:
|
m-n |
0 |
1 |
2 |
3 |
|
含氧酸强度 |
弱 酸 |
中 强 |
强 |
很 强 |
|
实 例 |
HClO |
H3PO4 |
HNO3 |
HClO4 |
(1)规则判断H3AsO4、H2CrO4、HMnO4酸性由强到弱的顺序为_________________。
(2)H3PO3和H3AsO3的形式一样,分子结构相同,但酸性强弱相差很大,已知H3PO3为中强酸,H3AsO3为弱酸。试推断H3PO3和H3AsO3的分子结构式分别为_________和 。
60、在有机反应中,反应物相同而条件不同得到不同的主要产物,下式中的R代表烃基:如:
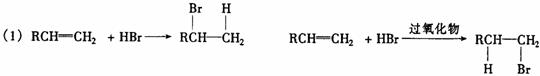
(请注意:H和Br所加成的位置)
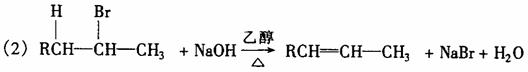 写出实现下列转变的各步反应的化学方程式,特别注意写明反应条件:
写出实现下列转变的各步反应的化学方程式,特别注意写明反应条件:

反应方程式:
(1) ;
(2)
59、以油脂为原料可以制取高级脂肪酸和甘油,也可以用来制取肥皂。工业上制高级脂肪酸和甘油时选择(酸性、碱性、中性)_____ __条件,其反应类型为___________,化学方程式为__________ ___________;若制取肥皂和甘油,则选择_____________条件,其反应类型为_______________,化学方程式为_________ __ ____。
58、某有机物中只含C、H、O三种元素,相对分子质量为46,2.3g该物质完全燃烧后生成0.1mol二氧化碳和27g水,该化合物的分子式为 根据C、H、O三种元素在有机物中的价键特征,请你推测乙醇具有的可能的结构简式:
57、如下图,某气体X可能由H2、CO、CH4中的一种或几种组成。将X气体燃烧,把燃烧后生成的气体通过A、B两个洗气瓶。试回答下列问题:
(1)若A洗气瓶的质量增加,B洗气瓶的质量不变,则气体X是____________。
(2)若A洗气瓶的质量不变,B洗气瓶的质量增加,则气体X是____________。
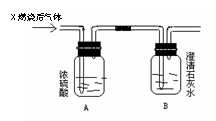 (3)若A、B两个洗气瓶的质量都增加,则气体X可能是____________。
(3)若A、B两个洗气瓶的质量都增加,则气体X可能是____________。
56.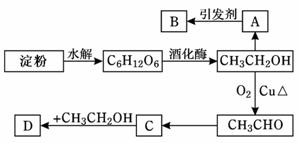 (11分)某人设计淀粉利用方案如下图所示:
(11分)某人设计淀粉利用方案如下图所示:
其中:A是 乙烯能催熟水果,B是高分子化合物,D是有水果香味的物质。请回答以下问题:
乙烯能催熟水果,B是高分子化合物,D是有水果香味的物质。请回答以下问题:
(1)“C6H12O6”的名称是________,A的电子式为__________,C中含有官能团名称 ;
(2) A→B反应类型_________________;C→D反应类型_________________
(3)写出下列转化的化学方程式
①A→B: ,
②C→D: ,
③CH3CH2OH→CH3CHO: 。
55.(13分)水是生命之源,也是化学反应中的主角。请回答下列问题:
Ⅰ、氢气燃烧生成液态水热化学方程式是2H2(g)+O2(g) =2H2O(l) ΔH=-572kJ/mol,
(1)生成物能量总和 (填“大于”、“小于”或“等于”)反应物能量总和。
(2)若2 mol氢气完全燃烧生成水蒸气,则放出的热量 572 kJ(填“>”、“<”或“=”)。
 (3)氢气热值为
。
(3)氢气热值为
。
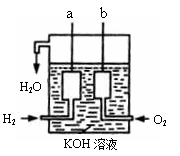
Ⅱ、氢气和氧气反应生成水,将化学能转化为电能,其构造如右图所示:a、b两个电极均由多孔的碳块组成,
(1)a电极反应式是
(2)b电极反应式是
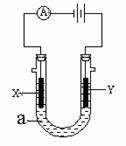 Ⅲ、右图表示一个电解池。X、Y都是惰性电极,电解液a是饱和食盐水,同时在两边各滴入几滴酚酞试液。
Ⅲ、右图表示一个电解池。X、Y都是惰性电极,电解液a是饱和食盐水,同时在两边各滴入几滴酚酞试液。
(1)X极上的电极反应式为 ,
在X极附近观察到的现象是 。
(2)Y极上的电极反应式为 ,
检验该电极反应产物的方法是 。
54.(10分)粉煤灰是燃煤电厂的工业废渣,其中含莫来石(Al6Si2O13)的质量分数为38%,还有含量 较多的SiO2。用粉煤灰和纯碱在高温下烧结,可制取NaAlSiO4,有关化学反应方程式:Al6Si2O13+3Na2CO3
→2NaAlSiO4 + 4NaAlO2+3CO2↑结合上述反应完成下列填空:
较多的SiO2。用粉煤灰和纯碱在高温下烧结,可制取NaAlSiO4,有关化学反应方程式:Al6Si2O13+3Na2CO3
→2NaAlSiO4 + 4NaAlO2+3CO2↑结合上述反应完成下列填空:
(1)上述反应所涉及的元素中,原子核外电子数最多的元素在周期表中的位置是________________,其氧化物属于 晶体。
(2)上述元素中有三种元素在元素周期表中处于相邻位置,其原子半径从大到小的顺序为
> > (用元素符号表示)。
(3)二氧化碳分子的空间构型为 型。
(4)上述元素中有两种元素是同一主族,可以作为判断两者非金属性强弱的依据的是
 (填编号)。
(填编号)。
a.该两种原子形成的共价键中共用电子对的偏向 b.最高价氧化物熔沸点高低
c.最高价氧化物对应水化物的酸性强弱 d.单质与酸反应的难易程度
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com