
33.[生物-----现代生物科技专题 10分]
花椰菜易受黑腐病菌的危害而患黑腐病,野生黑芥具有黑腐病的抗性基因。用一定剂量的紫外线处理黑芥原生质体可使其染色体片段化,并丧失再生能力。再利用此原生质体作为部分遗传物质的供体与完整的花椰菜原生质体融合,以获得抗黑腐病杂种植株。流程如下图。
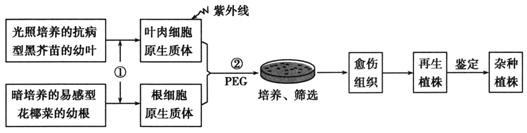 据图回答下列问题:
据图回答下列问题:
(1)过程①所需的酶是________________________。
(2)过程②后,在显微镜下观察融合的活细胞中有供体的____________存在,这一特征可作为初步筛选杂种细胞的标志。
(3)融合的原生质体经过____________再生,进而分裂和脱分化形成愈伤组织。
(4)对杂种植株进行__________________接种实验,可筛选出具有高抗性的杂种植株。
(5)此项技术具有________________________ 的优点
龙岩一中2014届高考模拟试卷
32.(13分)[化学——有机化学基础]
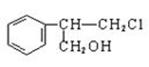 有甲、乙、丙三种物质:
有甲、乙、丙三种物质:

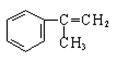
甲 乙 丙
⑴ 乙中能发生消去反应的官能团为____________________。
⑵由甲转化为乙需经下列过程(已略去各步反应的部分产物,下同):
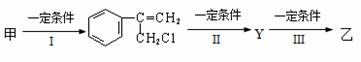
反应II的条件是NaOH溶液、加热;反应III的化学方程式为________________________
(不需注明反应条件)。
⑶由甲出发合成丙的路线之一如下:
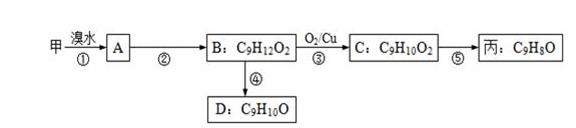
①下列物质不能与B反应的是___________(选填序号)。
a.金属钠 b.FeCl3溶液 c.Na2CO3溶液 d.HBr溶液
②C的结构简式为 __________________________;第⑤步反应类型______________________
③任写一种能同时满足下列条件的D的同分异构体的结构简式______________________。
a.苯环上的一氯代物有两种 b.遇FeCl3溶液发生显色反应 c.能与Br2/CCl4发生加成反应
31(13分).[化学——物质结构与性质]
I.氮族元素包括N、P、As、Sb和Bi五种元素。
(1)下列关于氮族元素的说法正确的是 。
a.N2可用于填充霓虹灯,其发光原理是电子从能量较低的轨道跃迁到能量较高的轨道时以光的形式释放能量
b.P、Na、S三种元素的第一电离能由大到小的顺序是:P>S>Na
c.基态As原子中,电子占据的最高能级为4d
d.Bi原子中最外层有5个能量相同的电子
(2)NH3在水中的溶解度比PH3大得多,其原因是 。
向硫酸铜溶液中先加过量氨水,后加适量乙醇,溶液中析出深蓝色的[Cu(NH3)4]SO4晶体,
该晶体中不含有的化学键是 。
A.极性键 B.非极性键 C.离子键 D.配位键 E.氢键
Ⅱ. 第四周期金属与人类的生产生活息息相关。
(3)目前市售的发光二极管,其材质以砷化镓(GaAs) 为主。已知镓是与铝同族,镓的基态原子的电子排布式是 。GaAs中Ga的化合价为 。
(4)金属钛坚硬、强度大、耐热、密度小,被称为高技术金属。TiCl4在常温下是无色液体,在水或潮湿空气中易水解而冒白烟, 则TiCl4属于 (填“原子”“分子”或“离子”)晶体。
(5) 钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,其中一种的化学式为[Co(NH3)5Br]SO4,往其溶液中加BaCl2溶液时,产生白色沉淀; 往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时, 产生淡黄色沉淀,则第二种配合物的化学式为 。
30.[物理选修3-5](本题共有两小题,每小题6分,共12分。每小题只有一个选项符合题意)
 (1)氦原子被电离一个核外电子后,形成类氢结构的氦离子。已知基态的氦离子能量为E1=-54.4 eV,氦离子能级的示意图如图所示。在具有下列能量的光子中,不能被基态氦离子吸收而发生跃迁的是 (填选项前的字母)
(1)氦原子被电离一个核外电子后,形成类氢结构的氦离子。已知基态的氦离子能量为E1=-54.4 eV,氦离子能级的示意图如图所示。在具有下列能量的光子中,不能被基态氦离子吸收而发生跃迁的是 (填选项前的字母)
A.40.8 eV B.43.2 eV
C.51.0 eV D.54.4 eV
(2)半径相等的两个小球甲和乙,在光滑的水平面上沿同一直线相向运动,若甲球质量大于乙球质量,发生碰撞前,两球的动能相等,则碰撞后两球的状态可能是 (填选项前的字母)
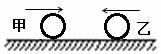 A.甲、乙两球的动量相同
A.甲、乙两球的动量相同
B.甲球的动量不为零,乙球的动量为零
C.两球的速度方向相同,而且它们动能仍相等
D.两球的速度方向均与原方向相反,但它们动能仍相等
29.[物理选修3-3](本题共有两小题,每小题6分,共12分。每小题只有一个选项符合题意)
(1)下列关于热学现象和热学规律的说法,正确的是 (填选项前的字母)
A.布朗运动就是液体分子的无规则运动
 B.物体的温度为0℃时,物体分子的平均动能为零
B.物体的温度为0℃时,物体分子的平均动能为零
C.第二类永动机不可能制成是因为它违背了热力学第二定律
D.热量能从高温物体传到低温物体,但不可能从低温物体传到高温物体
(2)一定质量的理想气体,经历了如图所示l→2→3状态变化的过程,
则三个状态的热力学温度之比是 (填选项前的字母)
A.1∶3∶5 B.3∶6∶5 C.3∶2∶1 D.5∶6∶3
28.(12分)家蚕(2n=56)属于ZW型性别决定的二倍体生物,其中ZZ为雄性,ZW为雌性,幼蚕斑纹由复等位基因AB(黑色斑)、AS(黑缟斑)、A(普通斑)、a(素斑)控制,前者对后者所有基因均完全显性,且基因位于2号染色体上。请回答下列问题:
(1)若对家蚕基因组进行研究,需对 条染色体中的DNA进行测序。幼蚕黑色斑是皮肤细胞产生并沉积黑色素形成的,这说明基因AB通过控制 从而间接控制斑纹性状。
(2)幼蚕斑纹由复等位基因的产生说明基因突变具有 的特点。
(3)某个体X与黑缟斑个体Y杂交,若子代有黑缟斑、普通斑与素斑三种类型,则个体X与Y的基因型分别为______。
(4)在基因型为Aa蚕卵的孵化过程中,用X射线进行处理,在雌蚕幼体中发现有少数个体表现为素斑、或为普通斑与素斑的嵌合体;另有少数普通斑雌蚕成熟后,其测交子代斑纹表现为伴性遗传。对这些变异类型进行研究,发现细胞中基因及染色体的变化如图所示(其他基因及染色体均正常)。
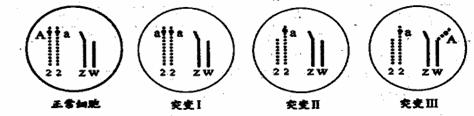
①若幼蚕的部分细胞为突变Ⅰ,则该突变发生的是时间是 。
②突变Ⅲ(基因型为aZWA)与正常个体测交,子代中雌蚕的基因型为____。
27.(12分)某湖泊的一条食物链是由a~d4种生物构成,各生物体内2种污染物的含量如图。
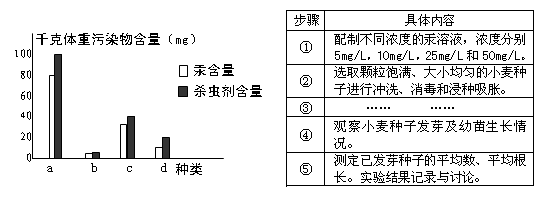
(1)从生态系统的组成成分看,b属于 。
(2)c同化的能量 (“多于”、“等于”或“少于”) a同化的能量,原因是 。
(3)如上表为“探究汞溶液对小麦种子萌发和幼苗生长发育的影响实验”的部分操作步骤。步骤③的具体内容是:取洁净的培养皿若干,分别适量且等量的加入蒸馏水和 ;再分别放入等量的小麦种子,盖好培养皿,置于适宜温度的恒温箱中培养5天。
(4)请完成下列记录实验结果的表格中①和②的相关内容。
|
实验组别 |
1 |
2 |
3 |
4 |
5 |
|
汞溶液浓度(mg/L) |
0 |
5 |
10 |
25 |
50 |
|
①
|
|
|
|
|
|
|
②
|
|
|
|
|
|
26.(16分)请回答有关绿色植物能量代谢的问题。
(1)下图是叶绿体的类囊体膜结构示意图:

①该场所产生的 将参与暗反应的 过程。图示中,叶绿素a(P680和P700)接受光的照射后被激发,能释放势能高的电子;提取P680和P700所用试剂为 。
②图中ATP合成酶除广泛分布于真核细胞的叶绿体类囊体薄膜上,还分布于真核细胞的_____膜上。
(2)为研究种植密度较高的玉米田中去叶对单株和群体产量的影响,研究者选取开花后3天的植株进行处理,从顶部去除不同数量叶片, 每隔13天测定穗位叶的叶绿素含量和光合速率(代表单株产量),同时在一定面积的样方中测定群体光合速率(代表群体产量),结果如下图。(备注:穗位叶位于植株中下部,其生长状况直接影响玉米籽粒中有机物的积累量。)

①由图1可知,去叶13天测定时,穗位叶的叶绿素含量随着__________而增大。
②由图2可知,随顶部去除叶片数量增加,______的光合速率持续增加,原因可能是穗位叶
③综合上述结果可推测,种植密度较高的玉米田中适度去除顶部叶片,可使玉米单株光合速率和群体光合速率__________。
25.(15分)我国化工专家侯德榜,改进氨碱法设计了“联合制碱法”,为世界制碱工业作出了突出贡献。生产流程如下:

(1)完成有关反应的化学方程式 ①沉淀池: NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl ②煅烧炉:
(2)联合制碱法的优点表述中,不正确的是___________
A.生产原料为:食盐、NH3、CO2
B.副产物氯化铵可做氮肥
C.生产过程中可循环利用的物质只有CO2
D.原料利用率高
某实验小组,利用下列装置模拟“联合制碱法”的第一步反应。
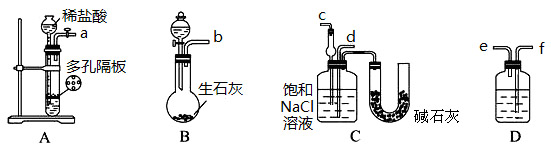
(3)上述装置中接口连接顺序为 ;
A.a接c;b接f、e接d B.a接d;b接f、e接c
C.b接d;a接e、f接c D.b接c;a接f、e接d
(4)D中应选用的液体为 。
为测定产品纯碱的成分和含量,做如下实验。假设产品纯碱中只含NaCl、NaHCO3杂质。
(5)检验产品纯碱中是否含有NaCl,可取少量试样溶于水后,再滴加 试剂。
(6)滴定法测定纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品W g,放入锥形瓶中加蒸馏水溶解,加1~2滴酚酞指示剂,用c mol/L的HCl溶液滴定至溶液由红色变为无色(指示CO32- +H+=HCO3-反应的终点),所用HCl溶液体积为V1 mL,再加1~2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄色变为橙色,所用HCl溶液总体积为V2 mL。则纯碱样品中NaHCO3质量分数为 。
24.(16分)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
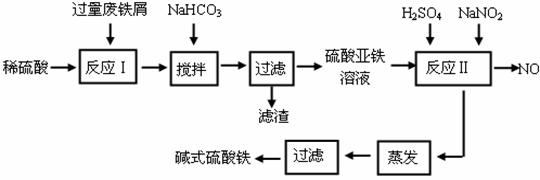
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
|
沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
|
开始沉淀 |
2.3 |
7.5 |
3.4 |
|
完全沉淀 |
3.2 |
9.7 |
4.4 |
回答下列问题:
(1)加入少量NaHCO3的目的是调节pH在 范围内。
(2)反应Ⅱ中加入NaNO2的目的是氧化亚铁离子,写出该反应的离子方程式为
。
(3)实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2体积为 11.2 L(标准状况),则相当于节约NaNO2的物质的量为 。
(4)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)42+ 聚合离子,该水解反应的离子方程式为 。
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为 。
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
(6)为测定含Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:准确量取20.00mL溶液于带塞锥形瓶中,加入足量H2O2,调节pH<3,加热除去过量H2O2;加入过量KI充分反应后,再用 0.1000 mol·L-1 Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。
已知:
则溶液中铁元素的总含量为 g·L-1。若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会 (填“偏高” “偏低” “不变”)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com