
49、为探究碱的性质,进行如下实验。
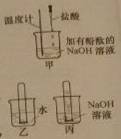 ①如右图(甲)所示,加入一定量的盐酸后,溶液红色褪去,溶液温度(16)(填“升高”、“降低”或“不变”)。
①如右图(甲)所示,加入一定量的盐酸后,溶液红色褪去,溶液温度(16)(填“升高”、“降低”或“不变”)。
②如右图(乙和丙)所示,同时将两支充满CO2的相同试管分别倒扣在等体积的水和NaOH溶液中,一段时间后,丙中液面高于乙,说明NaOH与CO2发生了反映,该反应的化学方程式为(17)。本实验中乙的作用是(18)。
③实验结束后,进行废液处理。将丙所得溶液全部倒入一大烧杯中,再将甲所得溶液缓慢加入。全部加入后测得溶液pH为3,调节pH接近7,达到排放标准。
将甲所得溶液缓慢加入的过程中,大烧杯内可观察到的现象是(19)。
48、氯化钠是一种重要的资源,在海水中储量很丰富。
①海水晒盐是海水在常温下蒸发得到氯化钠的过程,实验室用氯化钠溶液模拟该过程:

已知B溶液恰好是氯化钠的饱和溶液,与B溶液中溶质质量相等的溶液是(9)(填编号);与B溶液中溶质质量分数相等的溶液是(10)(填编号)。
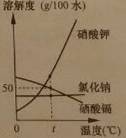 ②氯化钠、硝酸钾、硒酸镉的溶解度曲线如右图所示。据图回答:
②氯化钠、硝酸钾、硒酸镉的溶解度曲线如右图所示。据图回答:
溶解度变化受温度影响最大的是(11)。
t℃时,溶解度最小的是(12)。
t℃时,将25g硒酸镉加入(13)g水中,完全溶解后,恰好得到饱和溶液。要进一步提高该溶液的溶质质量分数,可进行的操作是(14)。
③硝酸钾溶液中含有少量氯化钠杂质,提纯的方法是(15)。
七、填空题
请根据要求在答题纸相应的位置作答。
47、化学有自己的语言,可以用国际通用的符号来表示物质的组成和变化。
①元素符号是最基本的化学语言。硅的元素符号是(1)。
②化学式是用元素符号表示物质组成的式子,如N2、CO、HCl、Al(OH)3、K2CO3,其中属于盐的是(2),空气中含量最多的是(3),易与血红蛋白结合的是(4)。
③化学方程式用于表示化学反应。氢气还原氧化铜的化学方程式是(5),其中氧化剂是(6)。
④碳酸氢钠(化学式:NaHCO3)常用于面包、馒头等食品的制作。碳酸氢钠中碳、氧元素的质量比为(7),1mol碳酸氢钠中含有(8)个氢原子。
46、碱石灰是NaOH与CaO的混合物,取一定量露置于空气中部分变质的碱石灰,加水充分搅拌后过滤,所得物质成分可能是
|
选项 |
A |
B |
C |
D |
|
滤液中的溶质 |
NaOH、Ca(OH)2 |
NaOH |
NaOH、Na2CO3 |
Na2CO3 |
|
滤渣 |
CaCO3、Ca(OH)2 |
Ca(OH)2 |
CaCO3、Ca(OH)2 |
CaCO3 |
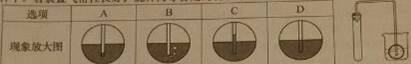
45、如下图,为检查装置的气密性,保持装置内温度不变,将导管的末端深入装有水的烧杯中。若装置的气密性良好,烧杯内导管处的现象(画圈部分)是
44、关于原子、分子叙述错误的是
A、分子都市由原子构成的 B、分子和原子都在不停运动
C、分子和原子在化学变化中都能够再分 D、分子和原子都市构成物质的微粒
43、除去溶液中的少量杂质,试剂选择正确的是
|
选项 |
溶液 |
杂质 |
试剂 |
|
A |
NaNO3 |
Na2CO3 |
适量BaCl2溶液 |
|
B |
CaCl2 |
稀盐酸 |
足量CaCO3固体 |
|
C |
ZnSO4 |
CuSO4 |
足量铜粉 |
|
D |
Fe2(SO4)3 |
Na2SO4 |
足量NaOH溶液 |
42、河水净化的主要步骤如下图所示。有关说法错误的是

A、步骤Ⅰ可出去难溶性杂质 B、X试剂可以是活性炭
C、步骤Ⅲ可杀菌、消毒 D、净化后的水是纯净物
41、工业上常把煤块粉碎后使其充分燃烧,其目的是
A、减少煤的浪费 B、减少氧气的消耗
C、减少二氧化碳的排放 D、减少酸雨的形成
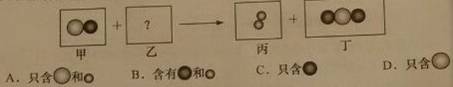
40、已知: 表示不同元素的原子。某反应的微观示意图如下,关于乙的构成说法合理的是
表示不同元素的原子。某反应的微观示意图如下,关于乙的构成说法合理的是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com