
7.玻璃、陶瓷和水泥是重要的无机非金属材料,它们的主要成分都含有的元素是
A.C B.S C.Si D.Cl
6.下列互为同位素的是
A.12C和13C B.正丁烷和丙烷
C.金刚石和石墨 D.葡萄糖和果糖
5.下列属于短周期元素的是
A.P B.Ca C.Fe D.I
4.下列物质的电子式书写正确的是

3.盛放氢氧化钠的试剂瓶上应贴的危险化学品标志是

2.碘是人体必需的微量元素,127I的中子数为74,则其原子序数为
A.201 B.127 C.74 D.53
1.天津市政府提出“建设生态宜居城市,创造美好生活环境”。下列措施中不能改善环境质量的是
A.充分利用太阳能、风能等 B.生活垃圾分类回收处理
C.推广使用新能源公交车 D.推广使用一次性塑料袋
0.6 mol m[CO(NH2)2]
 m[CO(NH2)2]==7.2 g
m[CO(NH2)2]==7.2 g
[答案] (1)B
(2)2Cl--2e-===Cl2↑
CO(NH2)2+3Cl2+H2O===N2+CO2+6HCl
( 3)不变 7.2
3)不变 7.2
3.步骤
(1) 根据现象或其他条件(如果是电解池,可以根据与电源正负极的连接情况),准确判定电极上发生氧化还原反应的类型和电极名称;
根据现象或其他条件(如果是电解池,可以根据与电源正负极的连接情况),准确判定电极上发生氧化还原反应的类型和电极名称;
(2)准确写出电极反应式;
(3)根据题目所给条件和所要求解的问题,使用上述合适的方法建立等量关系求解。
 (2012·重
(2012·重 庆高考节选)人工肾脏可采用间接电化学方法除去代谢产物中的尿素,原理如图。
庆高考节选)人工肾脏可采用间接电化学方法除去代谢产物中的尿素,原理如图。
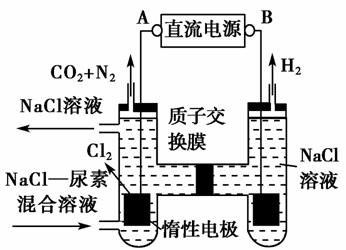
①电源的负极为________(填“A”或“B”)。
②阳极室中发生 的反应依次为_________、
的反应依次为_________、
________。
③电解结束后,阴极室溶液的pH与电解前相比将______;若两极共收集到气体13.44 L(标准状况),则除去的尿素为________g(忽略气体的溶解)。
L(标准状况),则除去的尿素为________g(忽略气体的溶解)。
[解析] (1)由图产生Cl2极为阳极知A为 正极,B为负极。
正极,B为负极。
(2)阳极室发生的反应依次为①2Cl--2e-===Cl2↑。
由产物CO2、N2知CO(NH2)2在此室反应被氧化,CO(NH2)2—→CO2+N2,发生还原反应的为Cl2。故方程式②为CO(NH2)2+3Cl2+H2O===N2+CO2+6HCl。
(3)阴极室2 H++2e-===H2↑。
H++2e-===H2↑。
阳极室产生的H+通过质子交换膜进入阴极室,从而使阴极室H+浓度保持不变。pH与电解前相比不变。
两极共收集到的气体n(气体)==0.6 mol
阳极 阴极
(N2+CO2)~3H2~ 6e-~CO(NH2)2
6e-~CO(NH2)2
5 mol 60 g
2.常用的三种方法
(1)根据电子守恒法计算:用于串联电路、阴阳两 极产物、正负两极产物、相同电荷量等类型的计算,其依据是电路上转移的电子数相等;
极产物、正负两极产物、相同电荷量等类型的计算,其依据是电路上转移的电子数相等;
(2)根据总反应式计算:先写出电极反应式,再写出总反应式,最后根据总反应式列比例式计算;
(3)根据关系式计算:由得失电子守恒关系找到 已知量与未知量之间的桥梁,得出计算所需的关系式。
已知量与未知量之间的桥梁,得出计算所需的关系式。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com