

37.(10分)下图是中学常见的几种物质之间的转化关系图(部分产物已略去)。其中A、D、H均为金属单质,F俗称食盐,K为红褐色固体。请按要求回答下列问题。
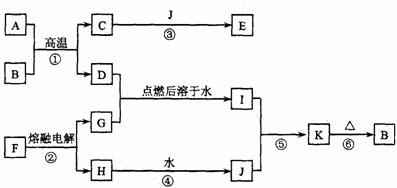
(1)组成A单质的元素在周期表中的位置为 。
(2)反应①为铝热反应,其化学方程式为 。
(3)反应③的离子方程式为 。
(4)上图中标有编号的反应中属于氧化还原反应的是(填编号) 。
(5)从海水中制得物质F的流程如下图所示,其中粗盐水所含的杂质离子主要为ca2+、 Mg2+、SO42—。
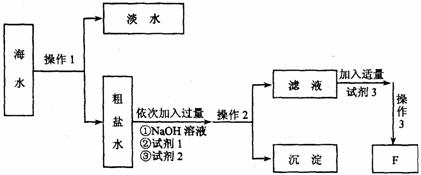
上述过程中操作3为蒸发结晶,则:
①操作1为 ,操作2为 ;
②试剂2是 ,试剂3是 。
36.(8分)下表列出了①~⑨九种元素在周期表中的位置。
    族 族周期 |
ⅠA |
  |
0 |
|||||
  1 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
|
2 |
② |
|
|
③ |
④ |
|
⑤ |
|
|
3 |
|
|
|
⑥ |
|
|
⑦ |
|
 4 4 |
⑧ |
|
|
|
|
|
⑨ |
|
请按要求回答下列问题。
(1)这九种元素中,原子半径最大的是(填元素符号) ;
元素⑤的原子结构示意图为 。
(2)⑧、⑥两种元素最高价氧化物对应的水化物中,酸性较弱的是(填化学式)
。
(3)③、④、⑤三种元素的气态氢化物中,稳定性最弱的是(填化学式) 。
(4)写出元素②的单质与水反应的化学方程式:
。
(5)写出元素⑦的单质与元素⑨的钠盐溶液反应的离子方程式:
。
35.设N为阿伏加德罗常数的值。下列叙述正确的是
A.0.1mol/LBaCl2溶液中含Cl—数目为0.2N
B.2.8gN2和CO的混合气体中含原子数目为0.2N
C.5.6gFe在足量Cl2中完全燃烧,转移电子数目为0.2N
D.2.24L(标准状况下)CH3COOH中含碳原子数目为0.2N
机密★启用前
2012年天津市普通高中学业水平考试
化 学
第Ⅱ卷
可能用到的相对原子质量,H 1 O 16 Cl 35.5 Ca 40
34.下列关于Na2CO3和NaHCO3的叙述中,正确的是
A.等质量Na2CO3和NaHCO3分别与足量盐酸充分反应,Na2CO3产生的CO2较多
B.Na2CO3溶液和NaHCO3溶液分别与足量盐酸反应的离子方程式相同
C.可用加热的方法除去NaHCO3中混有的Na2CO3杂质
D.常温下,Na2CO3比NaHCO3的溶解度大
33.为探究某食品包装袋内一小包脱氧剂中的还原铁粉是否变质,分别取少量样品溶于 盐酸,再进行下列实验,其结论正确的是
A.若再滴加KSCN溶液,溶液变红,说明铁粉变质
B.若再滴加KSCN溶液,溶液未变红,说明铁粉未变质
C.若再依次滴加氯水、KSCN溶液,溶液变红,说明铁粉全部变质
D.若再滴加KSCN溶液,溶液未变红,再滴加氯水,溶液变红,说明铁粉全部变质
32.下列有关氨的叙述中,正确的是
A.氨气极易溶于水,故只能用向上排空气法收集
B.氯化铵受热易分解,故可用加热氯化铵固体的方法制取氨气
C.氨气是一种重要的化工产品,工业上用氮气和氢气合成氨气
D.检验氨气可用湿润的蓝色石蕊试纸接近产生气体的导管口,观察试纸颜色变化
31.常温下,向4支试管中各加入3mL 5%的H2O2溶液,分别进行下列实验,关于实验现象的叙述正确的是
A.将试管置于40℃水中,试管中无明显变化
B.将试管置于5℃水中,试管中气泡明显增多
C.向试管中加入少量MnO2,试管中气泡明显增多
D.向试管中加入少量1mol/LFeCl3溶液,试管中无明显变化
30.下列关于铝的叙述中,正确的是
A.铝是地壳中含量最多的元素
B.铝在常温下不能与氧气反应
C.铝不能与强酸或强碱发生反应
D.电解熔融的氧化铝可制得铝单质
29.下列有关铁及其化合物的叙述中,不正确的是
A.铁能和沸水反应生成氢气
B.高温下用一氧化碳还原铁的氧化物制铁
C.将饱和氯化铁溶液滴入沸水中,煮沸至红褐色,可得氢氧化铁胶体
D.在盛有浑浊泥水的试管中加入少量硫酸铁,充分振荡、静置后上层液体变澄清
28.下列有关铝的化合物的叙述中,不正确的是
A.Al(OH)3可用作耐高温材料
B.Al2O3能和盐酸反应,得到AlCl3
C.Al(OH)3能和NaOH溶液反应,得到NaAlO2
D.向Al2(SO4)3溶液中滴加过量氨水,可得白色沉淀
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com