
7.胆固醇是人体必需的生物活性物质,分子式为C25H46O,有一种胆固醇酯是液晶材料,分子式为C32H50O2,生成这种胆固醇酯的酸是( )。
A.C6H13COOH
B.C6H5COOH
C.C7H15COOH
D.C6H5CH2COOH
解析:由分子式可知是一元酯,酯为酸和醇反应脱去水分子后的产物,所以酸的组成为酯加上一分子水减去醇,即生成胆固醇酯的酸为C6H5COOH。
答案:B
6.以下用于除去乙酸乙酯中乙酸和乙醇杂质的最好试剂是( )。
A.饱和碳酸钠溶液
B.氢氧化钠溶液
C.苯
D.水
解 析:饱和碳酸钠溶液能溶解乙醇,也能吸收乙酸,同时可降低乙酸乙酯的溶解度。
析:饱和碳酸钠溶液能溶解乙醇,也能吸收乙酸,同时可降低乙酸乙酯的溶解度。
答案:A
5.一定质量的某有机物与足量金属钠反应,可得VA L气体。相同质量的该有机物与适量的Na2C O3浓溶液反应,可得VB L气体。已知在同温、同压下VA和VB不相同,则该有机物可能是( )。
O3浓溶液反应,可得VB L气体。已知在同温、同压下VA和VB不相同,则该有机物可能是( )。
A.CH2 CHCOOH
CHCOOH
B.HOOC—COOH
C.CH3CH2COOH
D.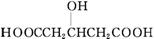
解析:有机物分子里的羟基和羧基都可以和金属钠反应放出氢气,而只有羧基和Na2CO3溶液反应放出CO2。所以,当有机物分子中只含羧基时,等质量的有机物分别与Na和Na2CO3反应,放出的气体体积相等;当有机物分子中既含羧基又含羟基时,与Na反应的官能团总比与Na2CO3反应的官能团多,所以VA总是大于VB,此时VA≠VB。
答案:D
4.炒菜时,往 往加入一些料
往加入一些料 酒和食醋
酒和食醋 ,这样可使菜变得味香可口,你认为其中的原因是( )。
,这样可使菜变得味香可口,你认为其中的原因是( )。
A.有盐类物质生成
B.有酸类物质生成
C.有醇类物质生成
D.有酯类物质生成
解析:一般酯类物质有香味,酒中的乙醇 和食醋
和食醋 中的乙酸反应生成
中的乙酸反应生成 乙酸乙酯。
乙酸乙酯。
答案:D
3.下列有关实验原理或操作正确的是( )。
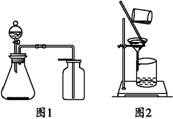
A.选择合适的试剂,用图1所示装置可分别制取少量CO2、NO和O2[来源:]
B.制备乙酸乙酯时,向乙醇中缓慢加入浓硫酸和冰醋酸
C.洗涤沉淀时(见图2),向漏斗中加适量水,搅拌并滤干
D.图2装置可用于分离乙酸和苯的混合物
解析:NO遇空气会发生反应2NO+O2 2NO2,NO只能用排水法收集;洗涤沉淀时,不能搅拌以免破坏滤纸;乙酸与苯互溶不能用图2装置分离,只有B项正确。
2NO2,NO只能用排水法收集;洗涤沉淀时,不能搅拌以免破坏滤纸;乙酸与苯互溶不能用图2装置分离,只有B项正确。
答案:B
2.相同物质的量浓度的下列物质的稀溶液中,pH最小的是( )。
A.乙醇 B.乙酸
C.氯化钠 D.碳酸
解析:pH越小,酸性相对越强,乙酸、碳酸溶液呈酸性,乙酸酸性强于碳酸,乙醇、氯化钠溶液均为中性。
答案:B
1.下列说法中不正确的是( )。
A.乙酸易溶于水和乙醇
B.无水乙酸又称冰醋酸,它是纯净物
C.乙酸是一种重要的有机酸,是有刺激性气味的液体
D.乙酸分子里有四个氢原子,所以不是一元酸
答案:D
12.(10分)
某化学兴趣小组用锌片、碳棒、硫酸铜溶液,其它器材自选组装一个原电池。
(1)画出该原电池的简易图(在图中注明锌片、碳棒、硫酸铜溶液)
(2)写出电极反应式:
正极: 负极:
连接好装置后,工作一段时间, 碳棒的质量增加了3.2g,锌减少的物质的量为_______mol。
 赛德国际学校2014年春季期中考试
赛德国际学校2014年春季期中考试
11.(22分)(Ⅰ).某有机物A的化学式为CnHm,若m =2.5n,则A可能的结构简式为___________________ , ___________________ ,若m =n=6,则A与液Br2在一定条件下反应的化学方程式为__________________________________________
(Ⅱ).A是一种重要的化工原料,它的产量可以衡量一个国家石油化工水平的高低。A、B、C、D在一定条件下存在如下转化关系(部分反应条件、产物被省略)。
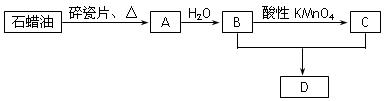
(1)写出A→B的反应方程式:
该反应的类型是____________________
 (2)使1molA与氯气发生完全加成反应,然后使该加成反应的产物与氯气在光照的条件下发生完全取代反应,则两个过程中消耗的氯气的总的物质的量是 mol
(2)使1molA与氯气发生完全加成反应,然后使该加成反应的产物与氯气在光照的条件下发生完全取代反应,则两个过程中消耗的氯气的总的物质的量是 mol
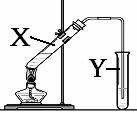
(3)实验室制备D的实验装置图如图所示:
①试管X中发生的化学反应方程式:_____________
②图中有一处明显的错误,该错误是_________________,收集产物的Y试管中盛放的液体为
(4)某同学在进行实验时(已纠正了图中的错误),在X试管中加入3mLB,然后边振荡试管边慢慢加入2mL稀硫酸和2mLC;连接好装置,加热,一段时间后,该同学始终没有观察到Y试管中有明显现象发生。分析其原因是_______________________________。
(5)在制备乙酸乙酯过程中,往往加入的乙酸和乙醇的量要比理论计算量多得多,请解析其中可能存在的原因:
①加热反应时,还没反应的乙醇和乙酸随产物一块被蒸出
②
10. (8分)将8mol NH3和10mol O2通入10L体积恒定的密闭容器中发生如下反应:4NH3(g)+5O2(g) 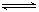 4NO(g)+6H2O(g),半分钟后达平衡,测得水蒸气的物质的量为4.8mol。
4NO(g)+6H2O(g),半分钟后达平衡,测得水蒸气的物质的量为4.8mol。
(1)此过程中υ(H2O)=____________ mol/(L·s)
(2)达平衡时,氧气的转化率为_____________,NH3的物质的量浓度为___________
(3)根据以上反应,下列有关说法中正确的是________
A.为了提高NH3的转化率,应适当提高O2的浓度
B.当4υ正(NO)=6υ逆(H2O)时,可以判断该反应达到平衡
C.达到平衡时,NH3、O2的浓度相等
D.升高温度可以使正反应速率增大,逆反应速率减小
F.加入催化剂可以同等程度的提高正反应速率和逆反应速率
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com