
5. 下列化合物分子内只有共价键的是( )
A. BaCl2 B. NaOH C. (NH4)2SO4 D. H2SO4
4. 性质递变规律中不正确的是( )
A. 离子半径:K+>Na+>O2->F-
B. 酸性:H2CO3<H3PO4<H2SO4<HClO4
C. 熔点:Al>Na>K>Rb
D. 热稳定性:SiH4<PH3<NH3<H2O
3. 不久前科学家将66 30Zn 和 208 82Pb 两原子核聚合放出一定数目的中子,得到112号新元素的原子,该原子的质量数为267。下列说法正确的是( )
A. 112号元素位于第8周期第VIII族
B. 该元素的原子属稳定同位素
C. 该元素是“两性”金属元素
D. 上述两原子核聚合时释放出7个中子
2. 下列说法正确的是( )
A. 12C、13C、14C、金刚石、石墨都是碳元素的的同位素
B. 同种元素的原子,质量数一定相同
C. 互为同位素的原子,质子数一定相同
D. 由一种元素组成的物质,一定是纯净物
一. 选择题:
1. 下列关于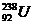 的说法正确的是( )
的说法正确的是( )
A. 中子数是146 B. 质子数是238
C. 质量数为330 D. 核外电子数为146
二、[典型例题]
例1. 可逆反应2NO2 2NO+O2在体积固定的密闭容器中,达到平衡状态的标志是( )
2NO+O2在体积固定的密闭容器中,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2,NO,O2表示的反应速率的比为 2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
A. ①④⑥⑦ B. ②③⑤⑦ C. ①③④⑤ D. 全部
解析:本题不仅考查了化学平衡的直接标志,也要求对化学平衡的间接标志进行分析,判断,需要对化学平衡的特征与化学平衡的关系进行全面分析才能顺利作答。①中单位时间内生成n mol O2必生成2n mol NO2,而生成2n mol NO2 时,必消耗n mol O2,①能说明达到平衡。②不能说明。③中属于化学反应速率与化学方程式中化学计量数的一般关系,无论达到平衡与否,都符合化学计量数之比。有色气体的颜色不变,则表示物质的浓度不再变化,能说明反应达到平衡;由于反应前后体积不同,故压强不变可作为平衡的标志。体积固定,气体质量前后守恒,密度不变,也不能说明达到平衡。由于气体总质量不变,气体的平均相对分子质量不变时,则说明气体中各物质的物质的量不变。
答案:A
点评:判断平衡状态,若利用速率判断,应注意速率的方向应是相向的,而不应是同向的。利用压强判断时,则应注意反应前后气体总体积应是变化的。而密度的依据,则应注意容器体积是否变化。
例2. 将CH4和C2H4的混合气体15g通入盛有足量溴水的容器中,溴水的质量增加了7g,则混合气体中CH4和C2H4的体积比是( )
A. 1:2 B. 2:1 C. 3:2 D. 2:3
解析:溴水增重原因是溴与乙烯发生了加成反应,增加的质量应是乙烯的质量,即7g,
则n(C2H4)=7g/28g/mol=0.25mol,n(CH4)=(15g-7g)/16g/mol=0.5mol,
故n(CH4):n(C2H4)=2:1。
答案:B
点评:溴水与乙烯加成生成的二溴乙烷是无色液体。
例3. A、B、C、D都是含有碳、氢、氧的单官能团化合物,A水解得B和C,B氧化可以得到C或D,D氧化也可得到C。若M(X)表示X的摩尔质量,则下式中正确的是( )
A. M(A)=M(B)+M(C) B. 2M(D)=M(B)+M(C)
C. M(B)< M(D)<M(C) D. M(D)<M(B)<M(C)
解析:由题意可知,A为酯,B为醇,C为羧酸,D为醛。
由醇到醛失去一定量氢原子,摩尔质量减少;由醇到酸,增加氧原子,摩尔质量增大。所以D选项符合题意。也可以任意选一组醇、醛、羧酸、酯为例,以它们的相对分子质量来观察4个选项,例如选择C2H5OH及与其相应的CH3CHO CH3COOH CH3COOCH2CH3来一一对照4个选项中摩尔质量的关系,即可确定选项D是唯一答案。
答案:D
点评:本题考查了“醇←→醛→羧酸”氧化链及“酯化反应与酯的水解反应”为可逆反应等有关知识,考查学生灵活运用所学知识解决问题的能力。
[模拟试题](答题时间:60分钟)
(三)重要的有机物
1. 有机化合物的性质
2. 有机化合物的结构特点
3. 重要的烃
4. 石油和煤
5. 饮食中的有机化合物
6. 高分子材料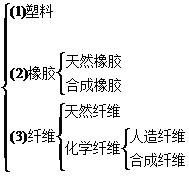
(二)化学键、化学反应与能量
1.
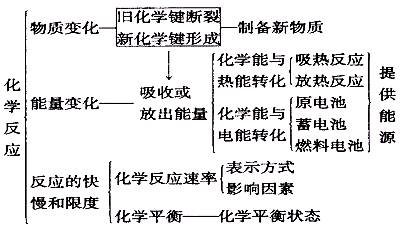
2. 
一. 知识分析
(一)原子结构与元素周期律
1.
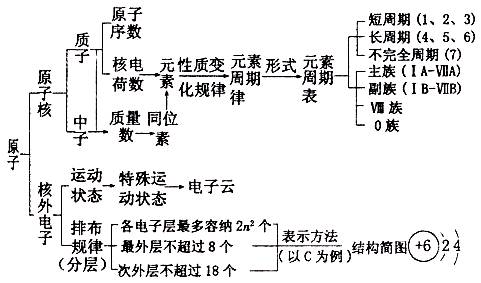
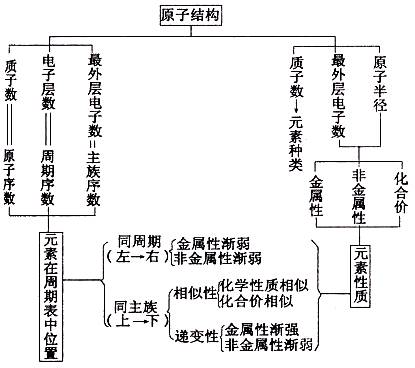
2. 位、构、性三者关系
26、在一个容积固定的反应器中,有一可左右滑动的密封隔板,左、右两侧分别进行如下可逆反应:2SO2(g)+O2(g)
 2SO3(g);
2SO3(g);
3Fe(s)+4H2O(g)

 Fe3O
Fe3O 4(g)+4H2(g)。左侧中加入SO2、O2、SO3的物质的量分别为x mol、3.25mol、1mol;右侧中加入9 mol的水蒸气和适量的铁粉(忽略铁粉对容器体积的影响)。
4(g)+4H2(g)。左侧中加入SO2、O2、SO3的物质的量分别为x mol、3.25mol、1mol;右侧中加入9 mol的水蒸气和适量的铁粉(忽略铁粉对容器体积的影响)。

当x在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于反应器位置2处。请填写以下空白:
(1)若x=1.5,则左侧反应在起始时向__________(填“正反应”或“逆反应”)方向进行。欲使反应维持向该方向进行,则x的取值范围是________________。
(2)若x=2,则左侧反应在起始时向__________(填“正反应”或“逆反应”)方向进行,平衡时混合气中SO2所占的体积分数为_________。
鹤岗一中2012—2013学年度下学期期末考试
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com