
7.(2014届福建龙岩市期末)全世界短年钢铁因锈蚀造成大量的损失。某城市拟用如图方法保护埋在酸性土壤中的钢质管道,使其免受腐蚀。关于此方法,下列说法不正确的是
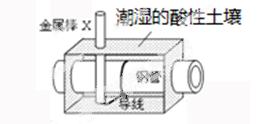
A.土壤中的钢铁易被腐蚀是因为在潮湿的土壤中形成了原电池
B. 金属棒X的材料应该是比镁活泼的金属
C.金属棒X上发生反应:M一ne一——Mn+
D.这种方法称为牺牲阳极的阴极保护法
[答案]B
[解析]
 8.(2014届扬州期末)电浮选凝聚法处理污水的原理如图所示。电解过程生成的胶体能使污水中的悬浮物凝聚成团而除去,电解时阳极也会产生少量气体。下列说法正确的是
8.(2014届扬州期末)电浮选凝聚法处理污水的原理如图所示。电解过程生成的胶体能使污水中的悬浮物凝聚成团而除去,电解时阳极也会产生少量气体。下列说法正确的是
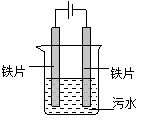

A.可以用铝片或铜片代替铁片 B.阳极产生的气体可能是O2
C.电解过程中H+向阳极移动 D.若污水导电能力较弱,可加入足量硫酸
 9.(2014届烟台期末)用下图装置模拟人工肾脏的工作原理,电解生成的Cl2将尿素[CO(NH2)2]氧化成N2排出,则下列说法错误的是
9.(2014届烟台期末)用下图装置模拟人工肾脏的工作原理,电解生成的Cl2将尿素[CO(NH2)2]氧化成N2排出,则下列说法错误的是
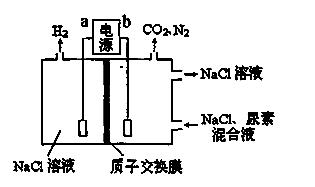
A.电源的正极为b
B.尿素被氧化的化学方程式为CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl
C.电解结束后,阴极室溶液与电解前相比pH增大
D.阳极收集到气体4.48 L(标准状况)时,被氧化的尿素为6.0 g
 10.(2014届海淀区期末)人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注。
10.(2014届海淀区期末)人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注。
(1)工业上常用高浓度的K2CO3 溶液吸收CO2,得溶液X,再利用电解法使K2CO3 溶液再生,其装置示意图如下:

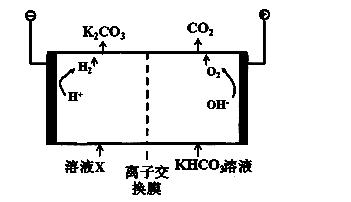
①在阳极区发生的反应包括 和H ++ HCO3- === H2O + CO2↑。
②简述CO32-在阴极区再生的原理 。
(2)再生装置中产生 的CO2和H2在一定条件下反应生成甲醇等产物,工业上利用该反应合成甲醇。
的CO2和H2在一定条件下反应生成甲醇等产物,工业上利用该反应合成甲醇。
已知:25 ℃,101 KPa下:
H2(g) + 1/2 O2(g) === H2O(g) Δ H1= -242 kJ/mol
CH3OH(g) + 3/2 O2(g) === CO2 (g) + 2 H2O(g) Δ H2= -676 kJ/mol
①写出CO2和H2生成气态甲醇等产物的热化学方程式 。
②下面表示合成甲醇的反应的能量变化示意图,其中正确的是 (填字母序号)。
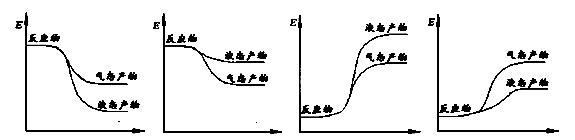
a b c d
(3)微生物燃料电池是一种利用微生物将化学能直接转化成电能的装置。已知某种甲醇微生物燃料电池中,电解质溶液为酸性,示意图如下:
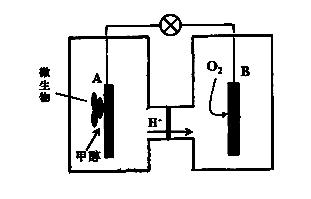
①该电池外电路电子的流动方向为 (填写“从A到B”或“从B到A”)。
②工作结束后,B电极室溶液的pH与工作前相比将 (填写“增大”、“减小”或“不变”,溶液体积变化忽略不计)。
(填写“增大”、“减小”或“不变”,溶液体积变化忽略不计)。
③A电极附近甲醇发生的电极反应式为 。
[答案](1)①4OH - - 4e- === 2H2O + O2↑(2分)
②1:HCO3
–存在电离平衡:HCO3 – H+ + CO32-
(1分),阴极H+放电浓度减小平衡右移(1分)CO32-再生
H+ + CO32-
(1分),阴极H+放电浓度减小平衡右移(1分)CO32-再生
答案2:阴极H+放电OH-浓度增大(1分),OH-与HCO3 –反应生成CO32- (1分)CO32-再生
(2)①CO2(g) + 3H2(g) === CH3OH(g)
+ H2O(g) △H = -50 kJ/mol(2分) ② a(2分)
+ 3H2(g) === CH3OH(g)
+ H2O(g) △H = -50 kJ/mol(2分) ② a(2分)
(3) ①从A到B(1分) ②不变(1分) ③CH3OH + H2O - 6e- === 6H++ CO2↑(2分)
[解析]

☆★名师预测★☆[来源:学&科&网]
[预测1]将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而 变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致该现象的主要原因是液滴之下氧气含量比边缘少。下列说法正确的是
变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致该现象的主要原因是液滴之下氧气含量比边缘少。下列说法正确的是
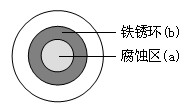 A.液滴中的Cl—由a区向b区迁移
A.液滴中的Cl—由a区向b区迁移
B.液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-=4OH-
C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b
区迁移,与b区的OH—形成Fe(OH)2,进一步氧化、脱水形成铁锈
D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,
则负极发生的电极反应为:Cu-2e-=Cu2+
[答案]B
[解析]
 [预测2]有人设计出利用CH4和O2的反应,用铂电极在KOH溶液中构成燃料电池。电池的总反应类似于CH4在O2中燃烧,则下列说法正确的是( )
[预测2]有人设计出利用CH4和O2的反应,用铂电极在KOH溶液中构成燃料电池。电池的总反应类似于CH4在O2中燃烧,则下列说法正确的是( )
A.每消耗1molCH4可以向外电路转移4mol电子
B.负极上CH4失去电子,电极反应式为CH4+10OH—=CO32—+7H2O+8e—
C.负极上是O2获得电子,电极反应式为:O2+2H2O+4e—=4OH—
D.电池放电后,溶液pH不断升高
 [预测3]下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极。
[预测3]下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极。
(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。
据此回答问题:
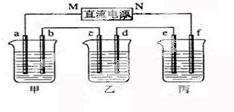
①电源的N端为 极;
②电极b上发生的电极反应为 ;
③列式计算电极b上生成的气体在标准状况下的体积: ;
④电极c的质量变化是 g;
⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因
甲溶液 ;乙溶液 ;丙溶液 ;
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?

 。
。
 (2)铜全部析出,可以继续电解H2SO4,有电解液即可电解。
(2)铜全部析出,可以继续电解H2SO4,有电解液即可电解。
5. (2014届海淀区期末)利用右图装置电解硫酸铜溶液,下列说法正确的是
(2014届海淀区期末)利用右图装置电解硫酸铜溶液,下列说法正确的是
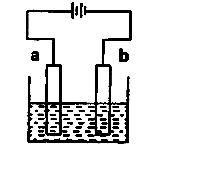
A.b电极上发生氧化反应
B.该装置能将化学能转变成电能
C.电解质溶液中Cu2+从b电极向a电极迁移
D.若a为铜,则a的电极反应式为:Cu-2e- === Cu2+
[答案]D
[解析]
试题分析:A、b电极为阴极,发生还原反应 ,错误;B、电解把电能转变为化学能,错误;C、根据电流的方向可推出,Cu2+从a电极向b电极迁移,错误;D、若a为铜,铜作阳极,失去电子,电极反应式为:Cu-2e-
=== Cu2+,正确。
,错误;B、电解把电能转变为化学能,错误;C、根据电流的方向可推出,Cu2+从a电极向b电极迁移,错误;D、若a为铜,铜作阳极,失去电子,电极反应式为:Cu-2e-
=== Cu2+,正确。
考点:本题考查电极原 理
理
6.(2014届资阳二诊)甲醇燃料电池工作 原理如右图,下列说法不正确的是
原理如右图,下列说法不正确的是
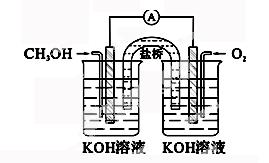
A.盐桥中的K+向负极移动
B.负极电极反应方程式为:CH3OH-6e-+8OH-=CO32-+6H2O
C.每消耗1 mol 甲醇,需消耗33.6 L 标况下的氧气
D.正极烧杯中溶液pH增大

4. (2014届陕西省宝鸡市第一次质检理综)优质的锂碘电池可用于心脏起搏器延续患者的生命,它的正极是聚2-乙烯吡啶(简写P2VP)和I2的复合物,电解质是固态薄膜状的碘化锂,电池的总反应为:2Li+P2VP·nI2
= P2VP·(n-1)I2
+2LiI,则下列说法正确的
(2014届陕西省宝鸡市第一次质检理综)优质的锂碘电池可用于心脏起搏器延续患者的生命,它的正极是聚2-乙烯吡啶(简写P2VP)和I2的复合物,电解质是固态薄膜状的碘化锂,电池的总反应为:2Li+P2VP·nI2
= P2VP·(n-1)I2
+2LiI,则下列说法正确的
A.该电池的电势低,使用寿命比较短
B.电池工作时,碘离子移向P2VP一极
C.聚2-乙烯吡啶的复合物与有机物性质相似,因此不会导电
D.正极的反应为:P2VP·nI2 + 2Li+ + 2e- = P2VP·(n-1)I2 + 2LiI
3. (2014届临沂市一模)下列有关电化学装置的说法正确的是
(2014届临沂市一模)下列有关电化学装置的说法正确的是
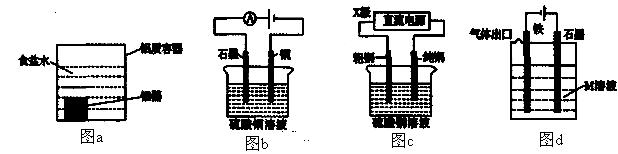
A.利用图a装置处理银器表面的黑斑Ag2S,银器表面发生的反应为Ag2S+2e-=2Ag+S2-
B.图b电解一段时间,铜电极溶解,石墨电极上有亮红色物质析出
C.图c中的X极若为负极,则该装置可实现粗铜的精炼
D.图d中若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀
2. (2014届洛阳市期末)如图是一种可充电的锂离子电池充、放电的工作示意图。该电池的反应式为:
(2014届洛阳市期末)如图是一种可充电的锂离子电池充、放电的工作示意图。该电池的反应式为:
LiMnO2 + C6充电放电Li1-x MnO2 + LixC6 (LixC6表示锂原子嵌入石墨形成的复合材料)下列有关说法正确的是
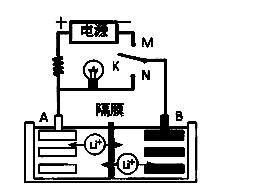
A.K与N相接时,A极为负极,该电极反应式为:LixC6 - xeˉ= C6 + xLi+
B.在整个充电或放电过程中都只存在一种形式 的能量转化
的能量转化
C.K与N相接时,Li+由A极区迁移到B极区
D.K与M相接时,A极发生氧化反应,LiMnO2 -xeˉ = Li1-xMnO2 + xLi+
1.(2014届福州市期末)A1-H2O2电池功率大,可作为许多机械的动力电池,其结构如右图所示。下列说法不正确的是
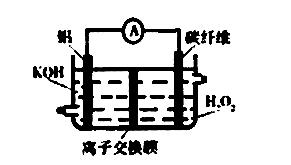
A.铝作负极,电池工作时将不断溶解
B.该电池不是二 次电池,不可充电
次电池,不可充电
C.碳纤维电极的电极反应是H2O2+2 e一+2H+ = 2 H2O
D.电池工作时OH一从碳纤维电极透过离子交换膜移向Al电极
2、关于充电电池的氧化还原问题是常考点,也是一个难点,但这类题还是有规律。原电池时,先要分析氧化剂与还原剂,氧化剂被还原、还原剂被氧化;充电时(电解池),原电池负极反应反着写为还原过程,发生在阴极,原电池中的正极反应反着写为氧化过程,发生在阳极。正极反应式颠倒即为阳极反应式,负极反应式颠倒即为阴极反应式。
☆★新题演练★☆
1、解决电化学一系列问题的基本步骤是:首先是判断是原电池,还是电解池―→根据题目条件判断出正负极(阴阳极)―→电极上的物质(阴阳离子)―→发生的电极反应―→带来的变化(离子浓度变化、pH变化、电子流向、现象等等)―→得出合理答案。
3.电解池的电极反应和总反应式的书写方法
(1)先检查阳极电极材料和确定溶液中的离子种类;
(2)由放电顺序确定放电产物和电极反应;
(3)将电极反应相加得总反应式。
☆★考场经验分享★☆
2.原电池电极反应式的书写除注意正确判断正、负极外,还应充分考虑介质的影响。一般而言,中性溶液中反应物不可出现H+和OH一;酸性溶液中反应物、生成物不会有OH一;碱性溶液中反应物、生成物不会有H+;水溶液中不会出现O2-。特别要注意的是介质还能影响正、负极的改变,如Mg-A1-NaOH原电池中,Mg为正极,Al为负极。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com