
一、选择题
1.下列四组物质的分子式都相同,按物质的分类方法属于同一类物质的是( )
A. 和CH2===CH—CH2CH2CH2CH3
和CH2===CH—CH2CH2CH2CH3
B.正戊烷和新戊烷
C.CH3—O—CH3和CH3CH2OH
D. 和
和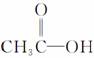
2.规律
( 1)在恒温、恒容的密闭容器里,对于反应前后气体体积不
1)在恒温、恒容的密闭容器里,对于反应前后气体体积不 等的可逆反应,当改变起始时加入物质的物质的量,通过可逆反应的化学计量数之比换算后各物质的量与原平衡的起始量相同,则两平衡等效。
等的可逆反应,当改变起始时加入物质的物质的量,通过可逆反应的化学计量数之比换算后各物质的量与原平衡的起始量相同,则两平衡等效。
如:2A(g) + B(g)3C(g) + D(g)
① 2 mol 1 mol 0 0
② 0 0 3 mol 1 mol
③ 1 mol 0.5 mol 1.5 mol 0.5 mol
按上述①、②、③三种形式进行反应时,达到平衡后是等效平衡。
(2)在恒温、恒容条件下,对于反应前后气体分子数不变的可逆反应,通过极值转化后,只要反应物(或生成物)的物质的量之比与原平衡的起始时之比相同,则达到平衡后与原平衡等效。
如:H2(g) + I2(g)2HI(g)
① 1 mol 1 mol 0
② 2 mol 2 mol 0
③ 0 mol 0 1 mol
④ 0 0 2 mol
⑤ 0.5 mol 0.5 mol 1 mol
其中①、②、③、④、⑤达到平衡后是等效的。
(3)在恒温、恒压条件下,无论反应前后气体的分子数是否相等,通过极值转化 后,反应物(或生成物)的物质的量之比与原平衡相同,则达到平衡后与原平衡等效。
后,反应物(或生成物)的物质的量之比与原平衡相同,则达到平衡后与原平衡等效。
如:2SO2 + O2 2SO3
① 2 mol 1 mol 0
mol 0
②  4
mol 2 mol 0
4
mol 2 mol 0
③ 0 0 2 mol
④ 0 0 4 mol
⑤ 1 mol 0.5 mol 1 mol
其中①、②、③、④、⑤达到平衡后是等效的。
 (2012·天津高考)已知2SO2(g)+O2(g)2SO3(g) ΔH=-197 kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲)2 mol SO2和1 mol O2;(乙) 1 mol SO2和0.5 mol O2;(丙) 2 mol SO3
。恒温、恒容下反应达平衡时,下列关系一定正确的是( )
(2012·天津高考)已知2SO2(g)+O2(g)2SO3(g) ΔH=-197 kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲)2 mol SO2和1 mol O2;(乙) 1 mol SO2和0.5 mol O2;(丙) 2 mol SO3
。恒温、恒容下反应达平衡时,下列关系一定正确的是( )
A.容器内压强p:p甲=p丙>2p乙
B.SO3的质量m:m甲=m丙>2m乙
C.c(SO2)与c(O2)之比为k:k甲=k丙>k乙
D.反应放出或吸收热量的数值Q:Q甲=Q丙>2Q乙
[解析] 因为反应2SO2(g)+O2(g)2SO3(g)在恒温、恒容的条件下进行。根据等效平衡的原理可知,甲与丙最后达到平衡时SO2、O2、SO3的物质的量、容器内的压强、SO2与O2的比值都相同;乙相当于在甲容器达到平衡后,将容器的体积瞬间扩大为原来的2倍。设甲达到平衡时容器内的压强为p甲,此时容器内瞬间压强减小为p甲/2,此时平衡向逆反应方向移动,气体的物质的量增加,SO3的质量减小,所以容器内气体的压强增大,则p乙>p甲/2,则2p乙>p甲=p丙,SO3的质量,m甲=m丙>2m乙,A错、B对;将甲容器达到平衡后瞬间将容器体积扩大2倍,平衡向逆反应方向移动,但是生成的SO2与O2的物质的量之比为2∶1,这与开始两者加入的物质的量之比相同,所以在此过程中SO2与O2的物质的量之比一直是2∶1不变,C错;甲与丙为等效平衡,但达到平衡时,甲容器中SO2的转化率与丙容器中SO3的转化率不一定相等,即Q甲不一定等于Q丙,D错。
[答案] B
 (2012·江苏高考)温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)===PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
(2012·江苏高考)温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)===PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
|
t/s |
0 |
50 |
150 |
250 |
350 |
|
n(PCl3)/mol |
0 |
0.16 |
0.19 |
0.20 |
0.20 |
下列说法正确的是( )
A.反 应在前50 s的平均速率v(PCl3)=0.003 2 mol·L-1·s-1
应在前50 s的平均速率v(PCl3)=0.003 2 mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol·L-1,则反应的ΔH<0
C.相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,反应达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0 mol PCl3和2.0 mol Cl2,达到平衡时,PCl3的转化率小 于80%
于80%
[解析] A项,v(PCl3)==0.001 6 mol·L-1·s-1,A错。B项,在温度为T时,平衡时c(PCl3)==0.10 mol· L-1,升高温度,平衡时c(PCl3)=0.11 mol·L-1,说明升高温度,平衡右移,则该反应为吸热反应,ΔH>0,B错。C项,在温度T时,由初始加入1.0 mol PCl5可得:
L-1,升高温度,平衡时c(PCl3)=0.11 mol·L-1,说明升高温度,平衡右移,则该反应为吸热反应,ΔH>0,B错。C项,在温度T时,由初始加入1.0 mol PCl5可得:
PCl5(g)PCl3(g)+Cl2(g)
初始物质的量: 1.0 mol 0 0
转化物质的量: 0.20 mol 0.20 mol 0.20 mol
平衡时物质的量:0.80 mol 0.20 mol 0.20 mol
其平衡常数K=
==2.5×10-2 mol·L-1,当充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2时,Qc===2.0×10-2 mol·L-1,Qc<K,故平衡右移,v(正)>v(逆),C正确。D项,因温度T时,充入1.0 mol PCl5等于充入1.0 mol PCl3和1.0 mol Cl2,设平衡时转化的PCl3物质的量为a,则:
PCl5(g)PCl3(g)+Cl2(g)
初始物质的量: 0 1.0 mol 1.0 mol
转化物质的量: a a a
平衡时物质的量:0.80
mol 0.20
mol  0.20 mol
0.20 mol
a=0.80
mol,PCl3的转化率为×100% =80%。
=80%。
现在相同温度下充入2.0 mol PCl3和2.0 mol Cl2,物质的量较原平衡加倍了,也相当于将原平衡体系的体积缩小到原来的一半,会使该平衡向生成PCl5的方向移动,故PCl3的转化率要升高,转化率大于80%。
[答案] C
1.含义:在一定条件(定温、定容或定温、定压)下,起始加入情况不同的同一可逆反应达到平衡后,任何相同组分的体积分数或物质的量分数均相同,这样的化学平衡互称等效平衡。
如常温常压下的可逆反应:
2SO2 + O22SO3
①2 mol 1 mol 0 mol
② 0 mol 0 mol 2 mol
③ 0.5 mol 0.25 mol 1.5 mol
①从正反应开始,②从逆反应开始,③正、逆反应同时开始。由于①、②、③三种情况如果按化学方程式的计量关系折算成同一方向的反应物,对应各组分的物质的量均相等(如将②、③折算为①),因此三者可建立等效平衡。
五、计算应用
19.(2011·江西中考)某地一辆满载浓硫酸的罐车翻倒,导致25 t溶质的质量分数为98%的浓硫酸泄漏,并向路基两边蔓延,接到报警后消防官兵立即赶来并用石灰浆(主要成分为氢氧化钙)中和硫酸解除了险情。请回答:
(1)25 t溶质的质量分数为98%的浓硫酸中含H2SO4的质量为______ t。
(2)计算:中和泄漏的硫酸,理论上需要多少吨氢氧化钙?
(3)处理一定量的浓硫酸,理论上既可用m1吨氢氧化钙粉末,也可选用m2吨氧化钙粉末,还可用m3吨碳酸钙粉末,则m1、m2、m3的数值大小关系为________。
18.(2011·四川达州中考)(10分)通过学习碱的性质,我校化学兴趣小组的同学对实验室的“氢氧化钙是否变质以及变质的程度”展开了探究活动,请你一同参与:
(1)提出问题:氢氧化钙是否变质?
(2)猜想与假设:同学们经过讨论认为样品存在三种可能情况:没有变质;部分变质;完全变质。
(3)实验探究:
|
实验步骤及操作 |
实验现象 |
实验结论 |
|
取样品于试管中,加入足量蒸馏水振荡,静置。 ①取上层清液,滴入无色酚酞溶液 ②倒去上层清液,再向试管中注入稀盐酸 |
①无色酚酞溶液变红 ②____________ |
部分变质 |
|
①无色酚酞溶液不变红 ②____________ |
____________ |
|
|
①____________ ②没有气泡产生 |
____________ |
(4)小结与思考:
①小蔓同学根据上述实验方案进行实验,确定该样品已部分变质,请写出实验中反应的化学方程式:__________________、__________________。
②氢氧化钙俗称熟石灰,农业上常用来______________。
四、实验探究
17.(8分)实验室新进一批浓硝酸,化学兴趣小组为研究该试剂的保存方法,开展相关探究。请根据要求回答问题:
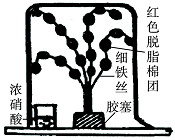
(1)打开盛装浓硝酸的试剂瓶,立即观察到瓶口有白雾产生。据此可知,浓硝酸具有____________(填一条物理性质)。为进一步证明浓硝酸具有该性质,兴趣小组设计如上装置(脱脂棉团因喷有稀氢氧化钠与酚酞混合液而呈红色)进行实验,实验过程中将观察到的现象是________________,发生反应的化学方程式为________________。
(2)将少量浓硝酸置于试管中,采用强光照射或者稍加热,立即观察到溶液上方有红棕色气体产生。据此现象可推知浓硝酸________________(填一条化学性质)。
(3)通过 上述两个实验可知,实验室应如何保存浓硝酸?
上述两个实验可知,实验室应如何保存浓硝酸?
_____ _________________________________
_________________________________ __________________________________。
__________________________________。
16.(8分)家庭厨房实际上就是一个化学世界,“柴米油盐酱醋糖”等都是化学物质。厨房内有一瓶无标签的液体,经步骤①:观察颜色与状态;步骤②:闻气味;步骤③:取该液体适量与一枚生锈的铁钉作用,看到铁锈逐渐溶解;步 骤④:另取少量该液体与纯碱反应,发现有气泡产生。确认该液体为食醋。根据上述实验回答下列问题:
骤④:另取少量该液体与纯碱反应,发现有气泡产生。确认该液体为食醋。根据上述实验回答下列问题:

(1)在上述①至④的四个步骤中,其中根据物质的物理性质来判断的有____________(填序号,下同),利用物质的化学性质来判断的有______________________。
(2)在步骤②中能闻到特殊气味,这是因为醋酸分子________________________的缘故。
(3)当食醋中的醋酸(CH3COOH)与纯碱反应时除有气泡生成外,还生成了醋酸钠(CH3COONa)和水,请写出该反应的化学方程式:______________________________。
三、情景分析
15.(7分)(1)小亮在化学晚会上观看了“瓶吞鸡蛋”的魔术(如下图1),瓶内发生反应的化学方程式是__________________。小亮思考:瓶能吞蛋,能不能吐蛋呢?他进行了如下图2的实验,他加入试剂P,结果鸡蛋吐了出来,试写出反应的化学方程式________________,吐蛋的原因是____________________。

(2)近年来,世界各地地震灾害频发。震灾 过后,饮用水的消毒杀菌成为抑制大规模传染性疾
过后,饮用水的消毒杀菌成为抑制大规模传染性疾 病爆发的有效方法之一。漂白粉是常用的消毒剂。漂白粉的主要成分是次氯酸钙[Ca(ClO)2]和氯化钙。工业上将氯气通入石灰乳[Ca(OH)2]来制取漂白粉,试写出该反应的化学方程式________________________。
病爆发的有效方法之一。漂白粉是常用的消毒剂。漂白粉的主要成分是次氯酸钙[Ca(ClO)2]和氯化钙。工业上将氯气通入石灰乳[Ca(OH)2]来制取漂白粉,试写出该反应的化学方程式________________________。
14.(2011·江西中考)(8分)如下图所示A~G是初中化学常见的物质。图中“→”表示转化关系, “—”表示相互能反应。已知A是人体胃液中含有的酸,G是最轻的气体,B、C、D、E、F是氧化物。请回答:
“—”表示相互能反应。已知A是人体胃液中含有的酸,G是最轻的气体,B、C、D、E、F是氧化物。请回答:

(1)G的化学式为______,E与F反应的基本反应类型是______,写出物质B的一种用途______________________;
(2)C与D反应的化学方程式可能是____________________。
13.(8分)通过化学学习,我们认识了“酸”和“碱”,请回答下列问题:
(1)常见的酸有硫酸、盐酸等,在它们的水溶液里由于存在相同的________(填符号),因此,它们有很多相似的化学性质,如:________________、____________________等(写两条即可)。
(2)碱有氢氧化钠、氢氧化钙等,氢氧化钠可作某些气体的干燥剂,如:干燥____气体,氢氧化钙可由生石灰与水反应制得,反应的化学方程式为________________________。
(3)酸和碱能发生中和反应,它在日常生活和工农业生产中有广泛的应用,如硫酸厂的污水中含有硫酸等杂质,可用熟石灰进行处理,反应的化学方程式为____________________。
(4)2010年4月14日青海玉树大地震灾害发生后,为了灾区人民群众的饮用水安全,卫生防疫部门要经常对灾区水源进行监测,获得可靠的科学依据。若现有一瓶水样,要获取它的酸碱度,应如何操作:________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com