
一、选择题
1.化学与生活息息相关,下列说法不正确的是( )
A.用食醋可除去热水壶内壁的水垢
B.淀粉、油脂和蛋白质都是高分子化合物
C.自行车钢架生锈主要是由电化学腐蚀所致
D.新型复合材料使用于手机、电脑使电子产品更轻巧、使用方便和新潮
解析 A项,水壶内壁的水垢主要成分是碳酸钙和氢氧化镁,用CH3COOH与碳酸钙、氢氧化镁发生复分解反应,A项正确;B项,淀粉和蛋白质是高分子化合物,而油脂是高级脂肪酸甘油酯,属于小分子(相对分子质量小于5 000),B项错误;C项,金属腐蚀大多数属于电化学腐蚀,即在湿润空气中构成原电池,不活泼的杂质为正极,铁等金属为负极,加速金属腐蚀,C项正确;D项,新型复合材料在日常生活中广泛应用,其质轻、耐腐蚀、耐高温等,D项正确。
答案 B
26.(7分)某混合物中含有碳酸钙和氯化钙,取该混合物6g,向其中加入一定质量的质量分数为10%的稀盐酸,恰好完全反应,产生2.2g气体。(假设气体全部逸出)。
计算:
(1) 所取混合物中碳酸钙的质量。
(2) 所加稀盐酸的质量
(3) 反应后所得溶液中的质量分数(计算结果精确到0.1%)
六.计算题
25.(3分)维生素C(C6H8O6)主要存在于蔬菜,水果中,它能促进人体生长发育,增强人体对疾病的抵抗力。计算:
(1)维生素C的相对分子质量__________________
(2)维生素C中碳、氢两种元素的质量比___________________(写最简比)
(3)维生素C中______元素的质量分数最大。
24.某钢铁厂高炉炼铁的主要原料是焦炭,赤铁矿石(主要含Fe2O3)、空气等,主要反映过程如下:

请回答:
(1) A的化学式___________。
(2) 反应②的化学方程式________________。
(3) 反应③的化学方程式________________。
(4) 向硝酸银和硝酸铜的混合溶液中,加入一定量的铁粉,反应停止后过滤,得到滤渣和滤液。向滤渣中滴加稀盐酸,无气泡产生,则滤渣中一定含有_________(填化学式),滤液中一定含有的溶质是_________(填化学式)。
(5) 用含杂质的铁10g(杂质不溶于水,也不参加反应)与100g稀硫酸恰好完全反应,滤去杂质,得到滤液质量为108.1g,则含杂质的铁中,铁的质量分数为_________________。
五.实验题
22.(7分)请结合下列实验装置,回答有关问题。
 (1)写出仪器名称 a__________ b_____________ CO2.
(2)实验室通过加热混有二氧化锰的氯酸钾固体制取氧气,在该反应中起催化作用的物质是_________.将装置A和C链接进行此实验,应现将导管移出水面,然后熄灭__________。
(3)实验室若用石灰石和稀盐酸制取并收集二氧化碳,选用的装置为_________(填字母),加试剂前,连接装置并检查装置的______________。将二氧化碳通入盛有蒸馏水的试管中,该试管中溶液的pH_______7(填“>”、“<”或“=”)
23.(4分)化学实验中经常用到一定溶质质量分数的溶液Na2CO3溶液也呈碱性。请回答:
(1)写出仪器名称 a__________ b_____________ CO2.
(2)实验室通过加热混有二氧化锰的氯酸钾固体制取氧气,在该反应中起催化作用的物质是_________.将装置A和C链接进行此实验,应现将导管移出水面,然后熄灭__________。
(3)实验室若用石灰石和稀盐酸制取并收集二氧化碳,选用的装置为_________(填字母),加试剂前,连接装置并检查装置的______________。将二氧化碳通入盛有蒸馏水的试管中,该试管中溶液的pH_______7(填“>”、“<”或“=”)
23.(4分)化学实验中经常用到一定溶质质量分数的溶液Na2CO3溶液也呈碱性。请回答:
(1) 实验室配制质量分数4%的氯化钠溶液50g。需要固体氯化钠的质量为_______g,水为__________mL(水的密度1g/cm3)。
(2) 若用质量分数为8%的氯化钠溶液配制50g质量分数为4%的氯化钠溶液。
①要8%的氯化钠溶液的质量为_________g。
②该溶液配制过程中除用到量筒、玻璃棒和胶头滴管外,还需要的仪器是______________。
21.(6分)在下图有关物质转化关系中,各物质均是初中化学常见的物质,其中A为红色金属单质,B能参与植物的光合作用。C、D为黑色粉末,F为可用于改良酸性土壤的碱,G为难溶性物质,H为难溶性蓝色物质(图中部分生成物已省略)。
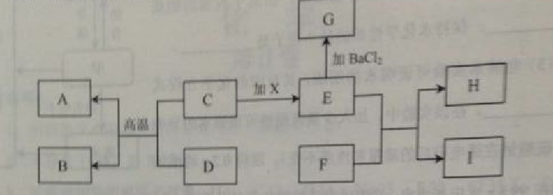
(1) 用化学式表示: D_________ G___________
(2) 写出E与F反应的化学方程式_________________________
(3) 光合作用生成的淀粉在人体内变成葡萄糖(C6H12O6),葡萄糖在酶的催化作用下发生缓慢氧化,同时放出热量,写出葡萄糖发生缓慢氧化反应的化学方程式_________________________________
20.(8分)甲乙丙三中固体物质的溶解度曲线如右图所示,回答下列问题。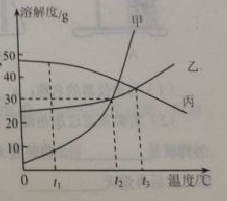
(1) t1℃时,甲乙丙三物质的溶解度由大到小的顺序是_____________。
(2) t2℃时,甲和乙的溶解度______(填“相等”或“不相等”)。
(3) t2℃时,甲物质的饱和溶液中溶质与溶剂的质量比为_________。(写最简比)
(4) t3℃将乙和丙两种物质的饱和溶液降低到t1℃,所得溶液中溶质的质量分数大小关系为:乙_____丙(填“>”、“<”或“=”)。
四.简答题
19.(6分)按要求书写方程式:
(1)氧化钙和水反应:__________________________。
(2)高锰酸钾受热分解:_____________________________。
(3)氢氧化钠溶液与盐酸反应:_________________________________。
18.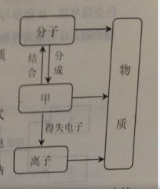 (7分)构成物质的粒子之间的关系如右图所示:
(7分)构成物质的粒子之间的关系如右图所示:
(1) 甲是_________;
(2) 在水,汞,氯化钠三物质中,由离子组成的物质是_________保持水化学性质的最小粒子是_____________。
(3) 电解水试验可证明水的组成,其反应的化学方程式为______________________。在该实验中,加入少量硫酸钠可增强水的导电性(在通电前后硫酸钠的质量和性质不变),现有0.2g硫酸钠溶解在99.8g水中并通电,当溶液中硫酸钠的质量分数为0.25%时,有______g水被电解。
17.(7分)铝在工业和日常生活中应用广泛。请回答:
(1) 铝元素的含量居地壳中所有元素的第________位。将铝块拉成细丝,是利用铝的_________性。
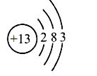
(2)
元素的化学性质与原子的最外层电子数有密切关系。右图为铝原子的结构示意图,铝原子在化学反应中容易_________(填“得到”或“失去”)电子。
(3) 铝在空气中与氧气反应,其表面生成一层致密的氧化物薄膜,从而阻止铝进一步氧化,因此铝具有很好的抗腐蚀性能。写出铝与氧气反应的化学方程式:______________________________________。
(4) 冰晶石在工业制取金属铝的过程中起着重要的作用。硫酸铝和氟化钠(NaF)在熔融条件下反应生成冰晶石(Na3AlF6),同时得到硫酸钠,写出此反应的化学方程式____________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com