
11.甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路,质子经内电路到达另一极与氧气反应,电池总反应式为2CH3OH+3O2―→2CO2+4H2O。下列关于该电池的分析:
①甲醇是负极 ②H+向负极移动 ③负极反应:CH3OH-6e-+H2O===CO2+6H+ ④1 mol CH3OH完全反应转移 12 mol电子 ⑤正极反应:O2+4e-+2H2O===4OH- ⑥该电池的电解质溶液可能是碱液。其中正确的是( )
A.①②⑥ B.②③④⑤
C.③ D.①③
答案 D
10.氢气是一种高效而无污染的理想能源。下列①~⑥是某化学兴趣小组的学生查阅资料归纳出的工业上制取氢气的方法,其中包括正在研究的方案。①电解法:2H2O2H2↑+O2↑;②甲烷转化法:CH4+H2OCO+3H2;③水煤气法:C+H2OCO+H2;④碳氢化合物热裂解法:CH4C+2H2;⑤设法将太阳光聚集产生高温使水分解:2H2O2H2↑+O2↑;⑥寻找高效催化剂使水分解产生H2。如果将来人类广泛使用H2作为能源,你认为可行且有发展前途的方法是( )
A.①⑤⑥ B.②⑤⑥
C.③⑥ D.④⑤⑥
答案 A
9.参照反应Br+H2→HBr+H的能量对反应历程的示意图,下列对上述正反应的叙述中正确的是( )
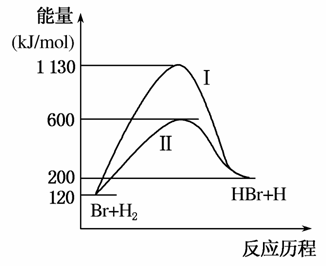
A.反应热:过程Ⅰ>过程Ⅱ
B.反应速率:过程Ⅱ=过程Ⅰ
C.该反应为吸热反应
D.过程Ⅰ使用了催化剂
解析 从图象可以分析,过程Ⅰ与过程Ⅱ中反应物的总能量与生成物的总能量均相等,故过程Ⅰ与过程Ⅱ的反应热相同;由于反应物的总能量小于生成物的总能量,所以该反应为吸热反应;由于过程Ⅰ所需要的能量大于过程Ⅱ,所以说明过程Ⅱ使用了催化剂,过程Ⅱ的反应速率比过程Ⅰ快。
答案 C
8.不足量的锌粉与100 mL 0.1 mol/L的稀硫酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( )
①加H2O ②加NaOH固体 ③滴入几滴浓盐酸 ④加CH3COONa固体 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液 ⑦升高温度 ⑧改用10 mL 1 mol/L硫酸
A.①⑥⑦ B.③⑤⑧
C.③⑦⑧ D.⑤⑦⑧
解析 本题要求增大反应速率但不能改变H2的产量,即与稀硫酸反应的锌的量不能改变,故排除⑥,也就排除了选项A;从影响反应速率的外界因素考虑,升高温度和增大H+的浓度,都能增大该反应的速率,③⑦⑧正确,而①②④⑤均是减小硫酸的浓度,故只有选项C正确。
答案 C
7.根据化学变化的实质是旧化学键断裂和新化学键形成这一观点,判断下列变化属于化学变化的是( )
A.干冰升华 B.H2在O2中燃烧
C.NaCl熔化 D.K2CO3溶于水
解析 干冰升华时只发生了状态的变化,CO2分子之间的距离增大了,但CO2分子并没有发生变化,但这个过程中既没有旧化学键断裂,也没有新化学键形成,因此干冰升华不属于化学变化;H2、O2和H2O分子内分别含有H—H键、O===O键和H—O键,当H2在O2中燃烧生成H2O时,原来的H—H键、O===O键都不存在了,形成了新的化学键即H—O键,因此H2在O2中燃烧属于化学变化;NaCl熔化时,虽然Na+与Cl-之间的离子键被破坏,但没有新的化学键形成,则NaCl熔化不属于化学变化;K2CO3溶于水时,K+和CO之间的离子键被破坏,但在该过程中同样没有新化学键的形成,也不属于化学变化。
答案 B
6.若R是元素周期表中第六周期第ⅦA族元素,下列有关R的叙述,正确的是( )
A.R的单质在通常情况下呈气态
B.R的单质可能是一种无色的固体
C.R的氢化物稳定
D.单质R与H2的化合反应非常困难
解析 第ⅦA族元素(即卤族元素)的单质从F2→Cl2→Br2→I2,颜色和状态依次为:淡黄绿色气体→黄绿色气体→深红棕色液体→紫黑色固体。根据元素周期律,位于第六周期第ⅦA族的元素R,其单质应该是比I2的颜色更深的固体,故A、B项均错误。从氟到碘,卤族元素的单质与H2化合越来越难,生成的氢化物的稳定性越来越弱,故C错误、D正确。
答案 D
5.X元素最高正价和最低负价绝对值之差为6,Y元素次外层有8个电子,YX2在水溶液中能电离出相同电子层结构的离子,则YX2是( )
A.MgCl2 B.CaCl2
C.BeCl2 D.CaBr2
解析 由题目信息知,X只能是ⅦA族元素,选项中只有CaCl2中Ca2+、Cl-均为18e-结构。
答案 B
4.元素A、B的原子序数都小于18,已知A元素最外层电子数为a,次外层电子数为b;B元素原子的M层电子数为(a-b),L层电子数为(a+b),则A、B两元素所形成的化合物的性质可能有( )
A.能与水反应 B.能与硫酸反应
C.能与NaOH反应 D.能与碳酸钠反应
解析 A元素的最外层电子数为a,外次层的电子数为b,可知b为2或8,但B元素的原子M层电子数为(a-b),L层电子数为(a+b),可知b只能是2,则a+b=8,a=6,即A为O元素,B为Si元素,则两元素形成的化合物为SiO2。SiO2不与水、硫酸反应,所以A、B项错;SiO2可与NaOH溶液反应,生成硅酸钠,C项正确;SiO2高温下也能与碳酸钠反应生成硅酸钠,D项正确。
答案 CD
3.有关化学用语正确的是( )
A.乙烯的实验式:C2H4
B.乙醇的结构简式:C2H6O
C.四氯化碳的电子式: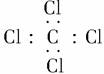
D.臭氧的分子式:O3
答案 D
2.114号元素(元素符号:Uuq)由设在杜布纳的核研究联合研究所的科学家在其核反应实验室里制成并确认。下列关于Uuq说法正确的是( )
A.Uuq原子的质量集中在原子核上
B.Uuq的原子核带负电荷
C.Uuq和Uuq互为同素异形体
D.Uuq的中子数为114
答案 A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com