
21.(10分)镁是一种性质活泼、用途广泛的金属,研究镁的冶炼和性质对于生产、生活意义重大。
目前世界上60%的镁是从海水中提取的。已知从海水中提炼镁的主要步骤如下:
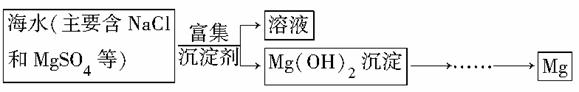
学生结合这个课题提出了以下问题:
(1)从海水中提取镁的过程中如何实现对镁的富集?
学生1的观点:直接往海水中加入沉淀剂。
学生2的观点:高温加热蒸发海水后,再加入沉淀剂。
学生3的观点:利用上述海水晒盐后剩余的溶液,加入沉淀剂。
请你评价三个学生提出的观点是否合理(填“是”或“否”),若不合理请简述理由。
|
观点 |
是否正确 |
简述理由 |
|
学生1 |
否 |
|
|
学生2 |
|
|
|
学生3 |
|
|
(2)从海水中提镁的过程中如何实现对镁的分离?
①过程中所用沉淀剂的制造原料也来源于海洋,则该沉淀剂是__________________(填化学式)。
②试从节约能源,提高金属镁的纯度分析,以下最适宜的冶炼镁的方法是________(填选项字母)。
A.Mg(OH)2MgO电解2 800 ℃Mg
B.Mg(OH)2MgOC,真空1 352 ℃Mg
C.Mg(OH)2①过量盐酸②△无水MgCl2电解714 ℃Mg
D.Mg(OH)2MgCl2溶液Mg
答案 (1)
|
|
|
|
|
|
|
|
|
|
否 |
海水中氯化镁浓度太小,直接加沉淀剂几乎不产生Mg(OH)2沉淀 |
|
|
是 |
高温蒸发海水后会使NaCl过饱和而析出,从而使Mg(OH)2沉淀中混有较多NaCl杂质 |
(2)①Ca(OH)2 ②C
20.(10分)乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平。请回答:
(1)乙烯的电子式为________,结构简式为________________。
(2)下列可以鉴别甲烷和乙烯的试剂为________(填选项字母)。
A.稀硫酸 B.溴的四氯化碳溶液
C.水 D.酸性高锰酸钾溶液
(3)下列物质中,不能通过乙烯加成反应得到的是________(填选项字母)。
A.CH3CH3 B.CH3CHCl2
C.CH3CH2OH D.CH3CH2Br
(4)已知2CH3CHO+O2催化剂△2CH3COOH,以乙烯为主要原料合成乙酸,合成线路如下图所示:
反应③的反应类型为________反应,反应②的化学方程式为_____________________________________________________________。
工业上以乙烯为原料可以生产一种重要的合成有机高分子化合物,该反应类型为________反应,其反应的化学方程式为_________________。
答案 (1)  CH2===CH2
CH2===CH2
(2)BD (3)B
(4)氧化 2CH3CH2OH+O2Cu或Ag△2CH3CHO+2H2O 加聚或聚合 nCH2===CH2―→?CH2—CH2?
19.(10分)已知X、Y、Z均为生活中常见金属单质,W为常见的气体单质,甲、乙为金属氧化物,且乙为红棕色固体,丙、丁为盐,其相互转化关系如图所示。

请回答:
(1)反应Ⅰ的化学方程式为__________________,工业上利用此反应原理还可以冶炼的金属为________(填选项字母)。
A.铜 B.银
C.钠 D.镁
(2)反应Ⅱ的化学方程式为______________________________,生成5.6 g金属Y,转移的电子数目为________NA。
(3)反应Ⅲ利用湿法冶金原理,在金属Y表面附着一层红色的金属Z,写出该反应的离子方程式____________________________,欲检验丁的水溶液中金属阳离子,需进行的操作为______________________________。
答案 (1)2Al2O3(熔融)4Al+3O2↑ CD
(2)2Al+Fe2O32Fe+Al2O3 0.3
(3)Cu2++Fe===Fe2++Cu 取少量丁的水溶液,加入少量KSCN溶液,无明显变化,然后再加入一定量新制氯水,若溶液变红,说明丁的水溶液中的阳离子为Fe2+
18.(7分)
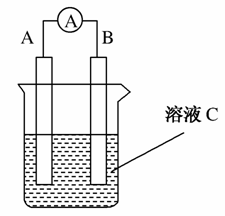
如图所示是原电池的装置图( 为电流表)。请回答:
为电流表)。请回答:
(1)若C为稀H2SO4溶液,电流表指针发生偏转,B电极材料为Fe且做负极,则A电极上发生的电极反应式为________________________;反应进行一段时间后溶液C的pH将________(填“升高”“降低”或“基本不变”)。
(2)若C为CuSO4溶液,A电极材料为Zn,B电极材料为石墨,电流表指针发生偏转,此时B为________极,反应一段时间后B电极上能够观察到的现象是
__________________________________________________________。
(3)若C为NaOH溶液,A电极材料为Al,B电极材料为Mg,负极上发生的电极反式为____________________。
答案 (1)2H++2e-===H2↑ 升高
(2)正 B上生成一种红色物质
(3)Al-3e-+4OH-===AlO+2H2O
二、非选择题
17.(8分)A、X、Y、Z和W是原子序数依次增大的五种短周期元素。A和X可组成两种常温下为液态的化合物A2X、A2X2、X和Y也可组成两种常温下为固态的化合物Y2X、Y2X2,且Y2X、Y2X2的焰色反应均为黄色。在元素周期表中,A与Y同主族,X与Z相邻,Z与W相邻。请回答:
(1)A2X2的结构式________,Y2X2的电子式________。
(2)X、Z两种元素的氢化物中熔沸点较高的是________(填化学式,下同);Z、W两种元素的最高价氧化物对应的水化物中酸性较强的是________。
(3)W元素在周期表中的位置为________;实验室制备W单质的化学反应方程式为______________________________;在上述反应中每生成1 mol W单质,转移的电子数目为________NA。
答案 (1)H—O—O—H Na+[××××××××]2-Na+
(2)H2O HClO4
(3)第三周期ⅦA族 MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O 2
16.下表为某有机物与各种试剂的反应现象,则这种有机物可能是( )
|
试剂 |
钠 |
溴水 |
NaHCO3溶液 |
|
现象 |
放出气体 |
褪色 |
放出气体 |
A. CH2CHCH2OH
B.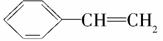
C.CH2CHCOOH
D.CH3COOH
解析 A项不与NaHCO3反应,B项不与Na、NaHCO3反应,D项不与溴水反应。
答案 C
第Ⅱ卷(非选择题,共52分)
15.下列有关有机化合物的性质和用途的说法正确的是( )
A.乙烯分子与苯分子中碳碳键不同,但二者都能发生加成反应
B.乙烷、乙烯、苯乙烯( 分子结构中都含有不饱和碳原子
分子结构中都含有不饱和碳原子
C.乙醇既可以作燃料,也可以在日常生活中使用,如无水乙醇可用于杀菌、消毒
D.淀粉、油脂、蛋白质都属于高分子化合物
解析 乙烯分子中的碳碳键为双键,苯分子中的碳碳键是介于单键、双键之间的独特的键,都可与H2等发生加成反应,A项正确;B项中乙烷中不含不饱和碳原子,C项中75%的乙醇可用于杀菌消毒,D项中油脂不属于高分子化合物,B、C、D项错误。
答案 A
14.下列说法正确的是( )
A.油脂、淀粉、蔗糖和葡萄糖在一定条件下都能发生水解反应
B.蛋白质是结构复杂的高分子化合物,分子中都含有C、H、O、N四种元素
C.棉、麻、羊毛及合成纤维完全燃烧都只生成CO2和H2O
D.根据分散质粒子的直径大小,分散系可分为溶液、浊液和胶体,浊液的分散质粒子大小介于溶液与胶体之间
解析 A项,葡萄糖是单糖,A项错;B项,蛋白质是氨基酸缩合而成的高分子化合物,都含有C、H、O、N四种元素,B项正确;C项,羊毛属蛋白质,为含氮化合物。合成纤维除含C、H、O元素外,有的还含有其他元素,如腈纶含N元素、氯纶含Cl元素等,它们完全燃烧时不都只生成CO2和H2O,C项错;D项,浊液的分散质粒子大小是大于胶体,大于10-7m(即大于100 nm),D项错。
答案 B
13.观察下列模型,是C、H、O中的两种或三种原子构成,下列说法错误的是( )
|
序号 |
1 |
2 |
3 |
4 |
|
模型示意图 |
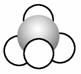 |
 |
 |
 |
A.模型1对应物质的二氯代物有2种
B.模型2对应物质的官能团是羧基
C.模型2对应物质可与模型3对应的物质发生酯化反应
D.模型4对应物质可以与氯气发生加成反应
解析 模型1是甲烷,甲烷是空间正四面体,其二氯代物只有1种,A项错误;模型2是乙酸,其官能团是羧基,B项正确;模型3是乙醇,可以与乙酸发生酯化反应,C项正确;模型4是乙烯,可以与氯气发生加成反应,D项正确。
答案 A
12.在一定温度下的某容积可变的密闭容器中,建立下列化学平衡:
C(s)+H2O(g)CO(g)+H2(g)
下列叙述中不能认定上述可逆反应在一定条件下已达到化学平衡状态的是( )
A.体系的压强不再发生变化
B.v正(CO)=v逆(H2O)
C.生成n mol CO的同时生成n mol H2O
D.1 mol H—H键断裂的同时断裂2 mol H—O键
答案 A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com