

请回答下列问题:
(1) 试剂1是________,试剂2是________(均填化学式)。
(2) A至H中,能发生银镜反应的是(写该物质的结构简式)_____ _____。
(3) G和D的结构简式分别是:G______________ ;D_____________。
(4) 反应类型:C→E ,E→F 。
(5) E转化为F的反应方程式是____________________________________________。
(6) 请写出符合下列条件的α-松油醇的同分异构体的结构简式
①有一个六元环 ②能发生银镜反应③含一个丙基
、
。
29.(22分)α-松油醇可经以下路线合成,小方框中的每一字母各代表一种有机物:
28.(14分)A~N均为中学化学中的常见物质,其中A是日常生活中不可缺少的物质,也是化工生产上的重要原料,单质M是目前使用量最大的金属,常温下B、E、F为气体,G为无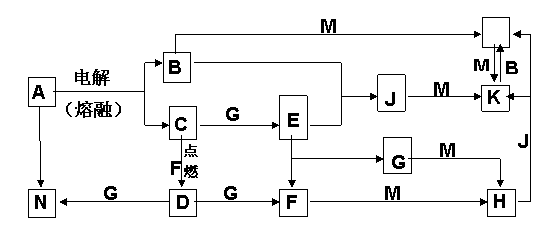 色液体,这些物质在一定条件下存在如下转化关系,其中有些反应物或生成物已经略去。回答下列问题:
色液体,这些物质在一定条件下存在如下转化关系,其中有些反应物或生成物已经略去。回答下列问题:
(1) H的化学式为__________ ,D的电子式 ______________________
(2)B与N反应的离子方程式为__________________________________。
(3)D与G反应的化学方程式为__________________________________。
(4)I可用于净化水,其原因为__________________________ _________ _______________________________________。(用相关的反应方程式和简要文字回答)。
(5)通常状况下, 1 g气体E在气体F中完全燃烧生成液态G时放出热量为a kJ,请写出表示E燃烧热的热化学方程式____________ ________________。
(6)I与NaOH溶液反应生成的沉淀再与NaOH和NaClO的混合液作用,是制备理想的绿色水处理剂(Na2MO4)的一种方法,试写出此反应的化学方程式_______________________。

② 实验过程中,使用分液漏斗滴加浓硫酸的操作是____________________________。
⑵ 将SO2气体分别通入下列溶液中:
① 品红溶液,现象是_____________________。
② 溴水溶液,现象是_____________________。
③ 硫化钠溶液,现象是____________________。
⑶ 有一小组在实验中发现,SO2氧化产生缓慢,以致后续实验现象很不明显,但又不存在气密性问题。请你推测可能的原因并说明相应的验证方法(可以不填满):
① 原因________________,验证方法___________________ ______________。
②原因____________,验证方法_______________________ _______________。
③ 原因____________ ,验证方法__________ ____。
27.(12分)研究性学习小组进行SO2制备及性质探究实验。
⑴ 根据反应:Na2SO3(固) + H2SO4(浓) == Na2SO4 + SO2↑+H2O,制备SO2气体。
① 用下列简图,在答题卡的方框中画出制备并收
集SO2的实验装置(含试剂)示意图。
② 步骤Ⅱ的目的是除铁。具体操作是:滴加H2O2溶液,稍加热;当Fe2+转化完全后,慢慢加入Cu2(OH)2CO3粉末,搅拌,以控制溶液pH=3.5;加热煮沸一段时间,过滤,用稀硫酸酸化滤液至pH=1。控制溶液pH=3.5的原因是______________ 。
③ 步骤Ⅲ的目的是得到CuSO4?5H2O晶体。操作是 ___ ,过滤,水浴加热烘干。水浴加热的特点是_______________ 。
⑵ 探究氧化铜的性质:
① 取A、B两支试管,往A中先加入适量CuO粉末,再分别向A 和B中加入等体积的3% H2O2溶液,只观察到A中有大量气泡,结论是________ 。
② 为探究试管A中反应的速率,收集气体并测定其体积必需的实验仪器有: __________________ 。
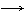
 工业CuSO4
CuSO4溶液
工业CuSO4
CuSO4溶液 
 CuSO4?5H2O …… CuO
CuSO4?5H2O …… CuO
① 步骤I的目的是除不溶性杂质,其操作是 。
26.(12分) 氧化铜有多种用途,如用作玻璃着色剂、油类脱硫剂等。为获得纯净的氧化铜以探究其性质,某同学用工业硫酸铜(含硫酸亚铁等杂质)进行如下实验:
|