
答案:B 【解析】本题是对燃料电池的考查。A项中正极反应应是2H2O+O2+4e-====4OH-;C项生成1 mol水需要2 mol电子,所以转移d mol电子生成(J/2 mol水,即9d g水;D项负极H2失电子生成H+,和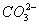 反应,所以
反应,所以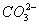 向负极移动。
向负极移动。
D.放电时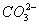 向正极移动
向正极移动
B.该电池负极反应式为:H2+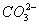 -2e-====CO2+H2O
-2e-====CO2+H2O
C.当电路中通过a mol电子时,则该电池理论上可供应
13.MCFC型燃料电池可同时供应电和水蒸汽,其工作温度为
A.该电池的正极反应式为:4
12.相同物质的量浓度的下列化合物的水溶液,按pH减小顺序排列的是( )
A.NaHSO4、NH4Cl、NaNO3、CH3COONa
B.NaHCO3、C6H5ONa、Na2CO3、CH3COONa
C.CH3COONa、NaNO3、(NH4)2SO4、NH4NO3
D.Na2CO3、NaHCO3、NH4Cl、NaHSO4
答案:D 【解析】本题考查的是弱离子水解程度的大小对溶液酸碱性的影响。一般规律:弱阳离子对应的碱的碱性越弱,水解程度就越大,则溶液的酸性就越强,相同的弱阳离子,浓度越大,对应的溶液的酸性就越强;同理弱阴离子对应的酸的酸性越弱,水解程度就越大,则溶液的碱性就强,相同的弱阴离子,浓度越大,对应的溶液的碱性就越强。而硫酸氢钠是强酸的酸式盐,能完全电离出H+,所以应该显酸性。根据上述规律可知答案是D。
11.在
A.13 B.14 C.15 D.无法计算
答案:A 【解析】本题考查的是酸碱中和与pH的计算。根据题意可知盐酸和氢氧化钠恰好中和,根据n(H+)=ri(OH-)可计算出x+y=13,所以A正确。
10.下列叙述正确的是( )
A.由多种非金属元素组成的化合物一定是共价化合物
B.含有金属元素的化合物一定是离子化合物
C.晶体熔化时化学键不一定断裂
D.晶体中只要有阳离子就一定有阴离子
答案:C 【解析】本题是对有关化学键知识的考查。NH4Cl是由非金属元素组成的化合物,但它是离子化合物,所以A错;AlCl3中含有金属元素,但它是共价化合物,所以B错;分子晶体融化时,化学键不断裂,所以C正确;在金属晶体中只有阳离子和电子而没有阴离子,所以D错。
9.在体积可变的密闭容器中进行可逆反应:2SO2
(g)+O2 (g)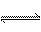 2SO3(g);ΔH<0并在一定温度下达到平衡。现改变某一条件,可以使正、逆反应速率均在改变条件的瞬间减小,并导致化学平衡向逆反应方向移动的是( )
2SO3(g);ΔH<0并在一定温度下达到平衡。现改变某一条件,可以使正、逆反应速率均在改变条件的瞬间减小,并导致化学平衡向逆反应方向移动的是( )
A.降低温度 B.保持体积不变充入一定量N2
C.保持压强不变,充入一定量Ar D.保持体积不变,充入SO3
答案:C 【解析】本题是对化学平衡移动的考查。A项中降低温度,正逆反应速率都减小,但平衡向放热方向移动,即向正向移动,所以A错;B项中在体积不变的情况下充入氮气,因反应物和生成物浓度不变,所以反应速率不变;C项冲压强不变,充入氩气,使体系的体积增大,从而使反应物和生成物浓度减小,反应速率减小,减压平衡向体积增大的方向移动,即逆向移动,所以C正确;D项体积不变,充入SO3,相当于增大了生成物的浓度,此时逆向反应速率增大,所以D错。
8.设NA代表阿伏加德罗常数,则关于热化学方程式:C2H2(g)+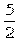 O2
(g)→2CO2 (g)+ H2O (g);ΔH=-1 300 kJ?mol-1的说法中正确的是( )
O2
(g)→2CO2 (g)+ H2O (g);ΔH=-1 300 kJ?mol-1的说法中正确的是( )
A.有10 NA个电子转移时,吸收1 300 kJ的热量
B.有NA个水分子生成且为液态时,放出1 300 kJ的热量
C.有NA对碳氧共用电子对生成时,放出1 300 kJ的热量
D.有8 NA对碳氧共用电子对生成,且水为气态时,放出1 300 kJ的热量
答案:D 【解析】本题是对阿伏加德罗常数和热化学方程式的考查。A项中AH<0应为放热反应,所以A项错。题目中放出1 300 kJ热量时,水为气态,当水为液态时放出的热量应大于1 300kJ,所以B错;一个CO2分子中有4对碳氧共用电子对,当生成8对共用电子对时放出的热量是1 300 kJ,所以C项错,D正确。
7.在两个容积相同的容器中,一个盛有NH3,另一个盛有N2、H2的混合气体,在同温同压下,两容器内的气体一定具有相同的( )
A.原子数 B.分子数 C.质量 D.密度
答案:B 【解析】本题是对原子数,分子数,质量等关系的考查。NH3是4原子分子,N2和H2是双原子分子。相同体积的NH,与N2和H2的混合气体原子数不同,体积相同即物质的量相同,所以分子数相同,所以B正确,两容器中气体的质量不一定相等,所以密度也不同。上易考网络(www.ekaonet.com)下最新高考资料
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com