
28.(10分)能源和环境是当今人类面临的两大问题。目前,化石燃料是人类生产、生活的主要能源。随着全球能源使用量的增长及不科学使用,化石燃料等不可再生能源将日益枯竭,并对环境产生严重影响。这就迫切要求人们开发氢能、太阳能等新能源。
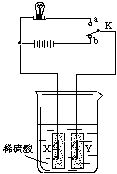 (1)氢能来源广泛,是高能清洁能源。氢气除了可直接燃烧获得热量外,还可设计成燃料电池。目前使用氢能还面临着氢气的制取和氢气的储存两个问题。右图为模拟氢、氧燃料电池的实验装置。
(1)氢能来源广泛,是高能清洁能源。氢气除了可直接燃烧获得热量外,还可设计成燃料电池。目前使用氢能还面临着氢气的制取和氢气的储存两个问题。右图为模拟氢、氧燃料电池的实验装置。
X、Y均为纱布袋做成的容器,装有活性炭,并与内部的石墨棒紧密接触,导线与石墨连接(石墨和活性炭都能导电)。把X、Y浸在水中,并在水中加一些稀硫酸,以增强水的导电能力。
当电键K与b接通,发生反应的化学方程式为________________________________________。
通电一段时间内没有看到气泡逸出,是因为活性炭具有_________________________性,从而解决了气体储存的问题。此时将电键K与a接通,灯泡发光,说明能量发生了如下转化:

 氢能 ________能 光能和热能。
氢能 ________能 光能和热能。
(2)一些常用燃料燃烧时的热值如下表:
|
燃料 |
天然气(以CH4计) |
液化气(以C4H10计) |
原煤(以C计) |
|
热值(kJ/g) |
约56 |
约50 |
约33 |
①目前不提倡直接用原煤作燃料的主要原因是:
a__________________________________ ,b______________________________________。
②化石燃料燃烧放出的CO2是一种温室气体,大量向空气中排放CO2将对气候产生负面影响。试通过计算说明,当上表中天然气和液化气充分燃烧获得相等的热量时,哪一种燃料放出的CO2较少?
27.(12分)燃烧是一种发光、发热的剧烈的化学反应。认识燃烧,科学地利用和控制燃烧,使燃烧为人类服务是十分重要的。
(1)物质燃烧一般需要同时满足三个条件,物质具有可燃性是燃烧的首要条件,下列物质中具有可燃性的是___________________(填物质的编号):
①石灰石 ②氮气 ③铁丝 ④红磷 ⑤面粉 ⑥二氧化碳
发生燃烧的另外两个条件分别是_____________________;______________________。
(2)下面是验证燃烧条件的实验装置图。
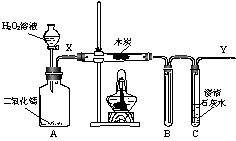
①简要叙述检验该装置气密性的方法:
_______________________________________________________________________________________
______________________________________________________________________________________。
②已知木炭是一种可燃物。请验证:木炭发生燃烧的另外两个条件中,缺少任何一个条件都不能燃烧(两个条件须分别验证),只有同时具备这两个条件才能燃烧。
在完成气密性检查后填装药品,并已设法在整个装置中充满了氮气。若要求实验过程中不得拆、装仪器,请设计后续的实验步骤,并按要求填表。
在后续实验步骤中,有一步骤为“盖灭酒精灯,待仪器恢复到常温”,请把这一步骤用“题示”两个字填入下表相应步骤的“操作”栏中,且不必填该步骤的“预计现象及得出的结论”栏。
|
步骤 |
操作 |
预计现象及得出的结论 |
|
① |
|
|
|
② |
|
|
|
③ |
|
|
|
④ |
|
|
(3)①有人建议在装置X处作下图Ⅰ所示的改动,以便可随时切断气流。这样的做法可能引起的不良后果是________________________________________________________________。
②又有人建议在实验开始后,在Y管末端处增添一个燃着的酒精灯(下图Ⅱ),大家讨论后觉得很有必要,请用化学方程式说明理由(不需要文字说明):
_________________________________________________________________________________。
|
|
26.(7分)利用中和反应可以测定酸或碱溶液中溶质的质量分数。例如,在一定量的待测酸(或碱)溶液中逐滴加入已知质量分数的碱(或酸)溶液(标准溶液),直到酸、碱正好完全反应,根据消耗标准碱(或酸)溶液的多少即可求算出待测酸(或碱)溶液的质量分数。
右图为某次测定过程中,溶液的pH随所滴加的某标准溶液体积的变化而变化的关系图。
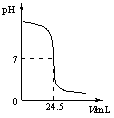 (1)根据右图曲线可以判断实验中是向_______(填“酸”或“碱”,下同)
溶液(待测液)中滴加__________溶液(标准液)。
(1)根据右图曲线可以判断实验中是向_______(填“酸”或“碱”,下同)
溶液(待测液)中滴加__________溶液(标准液)。
(2)在这次测定中,为了指示中和反应刚好完全,用酚酞作指示剂,即在 待测溶液中先滴入几滴酚酞试液,若看到_______________________ _____________________________,则证明中和反应正好完成。
(3)如果实验中使用的酸是硫酸,碱是氢氧化钠,且待测液和标准液的密度均以1.0g/mL计。若测定中取用待测液25mL,标准液溶质的质量分数为4.5%,根据图中数据,计算待测液溶质的质量分数。
25.(3分)中和反应是一类重要的化学反应,广泛应用于化学研究和工农业生产。中和反应过程中会放出热量。以下是在一定体积的10%的氢氧化钠溶液中滴加10%的盐酸(常温下)的反应中,溶液温度变化的数据:
|
加入盐酸的体积 (V)/mL |
2 |
4 |
6 |
8 |
10 |
12 |
14 |
16 |
18 |
20 |
|
溶液温度上升 (△t)/℃ |
5.2 |
9.6 |
12.0 |
16.0 |
18.2 |
16.7 |
15.7 |
14.7 |
13.7 |
12.9 |
 (1)试绘出溶液的温度变化(△t)与加入的盐酸体积(V)之间的关系曲线图:
(1)试绘出溶液的温度变化(△t)与加入的盐酸体积(V)之间的关系曲线图:
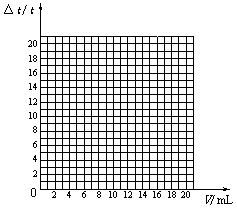
(2)请根据曲线变化的趋势,说明溶液温度变化的原因
24.(6分)以下是一些常见物质间互相转化的关系图(有些反应条件未注明)
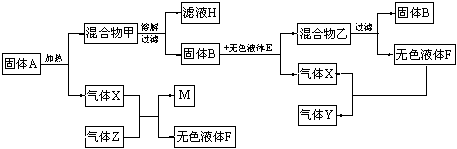
(1)将固体A充分加热至不再产生气体,滤液H中所含有的物质有: ____________________________________________(写化学式)
(2)固体B的化学式为______________,它在与无色液体E的反应中起____________作用。
(3)如果气体Z是最简单的有机物,它在气体X中燃烧,会因X的量的变化和条件的不同而生成不同的物质。试写出X和Z反应生成固体单质M和无色液体F的化学方程式:
______________________________________________________________。
23.(4分)将下列各名词填在与之相对应的空格中(只需填序号)。
①乳化 ②结晶 ③潮解 ④挥发
(1)氢氧化钠固体露置在空气中,表面变潮湿
(2)打开装有浓盐酸的试剂瓶瓶塞,瓶口出现白雾
(3)将洗洁精洗去餐具上的油污
(4)冷却热的硝酸钾饱和溶液,出现晶体
22.(4分)我们在初中化学里学过的一些物质,在实际生活中有重要的用途。现有以下4种物质:硝酸钾、稀硫酸、硫酸铜、干冰,请用它们(或其主要成分)的化学式填空。
(1)可用于配制杀菌剂波尔多液 _______________
(2)可用于除去铁锈 _______________
(3)可用于人工降雨 _______________
(4)可作为复合肥使用 _______________
21.(6分)(1)写出下列物质的化学式:
①亚铁离子_____________________;②硫酸铝____________________。
(2)化学反应在从古至今的生产中都起着非常重要的作用。请按要求写出化学方程式:
①古代的湿法炼铜___________________________________________________;
②工业上用赤铁矿炼铁_______________________________________________。
20.一定量的木炭在盛有氮气与氧气混合气体的密闭容器中充分燃烧后,生成CO和CO2,且测得反应后混合气体中碳元素的质量分数为24%,则其中氮气的质量分数可能为()
A.10% B.30% C.50% D.70%
第Ⅱ卷(非选择题 共60分)
19.下列除杂质所选用试剂正确的是()
A.用稀盐酸除去铜粉中的铁粉 B.用适量稀硫酸除去NaCl溶液中的Na2CO3
C.用浓硫酸吸收O2中的CO2气体 D.用稀盐酸除去Fe2O3中的CaCO3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com