
5.高芳同学把自制的一种黄色的花汁,分别加入到下列不同的试剂中,并如实记录了观察到的现象。
|
试剂 |
食醋 |
蔗糖水 |
蒸馏水 |
肥皂水 |
石灰水 |
|
颜色 |
红 |
黄 |
黄 |
绿 |
绿 |
请分析上表,并回答下列问题:
(1)已知棉花适宜生长土壤的pH为6.0-6.8,高芳家种的棉花生长状况良好,若用该花汁测量该棉花地土壤的酸碱性,花汁的颜色应显 色;
(2)蚊子、蜜蜂、蚂蚁等昆虫叮咬人体时,会向人体射入一种叫做蚁酸(具有酸的性质)的物质,使皮肤红肿、瘙痒,甚至疼痛。要缓解这种症状,可在叮咬处涂抹上述试剂中的 。
4.锂元素(元素符号为Li)及其所形成的化合物,在通讯和航空航天领域中具有极其重要的用途。它的化合物氢氧化锂(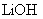 )是一种易溶于水的白色固体,有辣味,具有强碱性和腐蚀性。
)是一种易溶于水的白色固体,有辣味,具有强碱性和腐蚀性。
(1)写出氢氧化锂的一条物理性质 ;
(2)下表是部分物质的溶解性表,运用此溶解性表并结合你对复分解反应发生条件的理解,从表中选出一种盐,该盐能和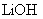 发生复分解反应。请你写出该盐的化学式:
。
发生复分解反应。请你写出该盐的化学式:
。
|
|
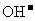 |
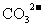 |
 |
 |
 |
溶 |
不 |
不 |
溶 |
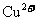 |
不 |
不 |
溶 |
溶 |
 |
溶 |
微溶 |
溶 |
溶 |
3.2008年北京奥运会火炬使用燃料是丙烷( ),这是一种价格低廉的燃料,它燃烧后火焰的颜色具有较好的可视性,其完全燃烧的产物不会对环境产生污染。请你写出丙烷完全燃烧发生反应的化学方程式
。
),这是一种价格低廉的燃料,它燃烧后火焰的颜色具有较好的可视性,其完全燃烧的产物不会对环境产生污染。请你写出丙烷完全燃烧发生反应的化学方程式
。
2.从分子的角度解释下列现象:
(1)食物腐败 ;(2)花香四溢 。
1.请用元素符号或化学式表示:
(1)2个氮原子 ; (2)3个氧分子 ;
(3)五氧化二磷 ; (4)天然气或沼气的主要成分 。
26.(10分)某化学研究小组对当地的石灰石样品进行了研究。称取石灰石样品8g,把40g稀盐酸分四次加入样品中,测得实验数据见下表(假设石灰石样品中杂质不溶于水、不与盐酸反应,二氧化碳不溶解)。
|
实验序号 |
加入稀盐酸的质量/g |
剩余物质的质量/g |
|
第1次 |
10 |
5.5 |
|
第2次 |
10 |
3 |
|
第3次 |
10 |
1.6 |
|
第4次 |
10 |
m |
(1)第4次剩余物质的质量m= g
(2)石灰石样品中CaCO3的质量分数为 。
(3)计算稀盐酸的溶质质量分数。
25.(12分)已知某混合金属粉末,除铝外还含有铁、铜中的一种或两种,所含金属的量都在5%以上。请设计实验探究该粉末中铁、铜的存在。
资料在线:铝与氢氧化钠溶液反应生成溶于水的偏铝酸钠和氢气(2Al+2H2O+2NaOH=2NaAlO2+3H2↑),铁和铜不与氢氧化钠溶液反应。
可供选择的实验用品:烧杯、大试管、量筒、滴管、燃烧匙、药匙、磁铁;稀硫酸、稀盐酸、NaOH镕液、氨水。
请你参与并完成以下实验探究过程:
Ⅰ、提出假设
假设1:该混合金属粉末中除铝外还含有Fe。
假设2:该混合金属粉末中除铝外还含有 。
假设3:该混合金属粉末中除铝外还含有Fe、Cu。
Ⅱ、设计并实施实验方案
(1)基于假设1,不用化学试剂,证明金属铁的存在 。
(2)基于假设2,将混合金属粉末加入足量稀盐酸,你观察到的现象是 ,反应的化学方程式为 。
(3)基于假设3,请你完成实验操作,描述实验现象。
|
实验步骤 |
实验操作(说明仪器和试剂) |
实验现象 |
结论 |
|
① |
|
|
仅除去铝 |
|
② |
|
|
证明含有铁 |
|
③ |
将大试管静置,弃去上层清液,加水,多次洗涤剩余固体 |
剩余固体呈紫红色 |
证明含有铜 |
24.(8分)某校化学活动小组查阅资料发现,粗盐中除NaCl外,还含有MgCl2、CaCl2、MgSO4以及泥沙等杂质,他们要除去杂质得到精盐,设计了下列实验方案(序号①~⑧表示实验操作,用于沉淀的试剂稍过量):

根据上述方案,回答下列问题:
(1)操作①中玻璃棒的作用是 。
(2)第⑤步操作的名称是 。
(3)“蒸发结晶”用到的器材有:铁架台(铁圈)、坩埚钳、石棉网、火柴、玻璃棒、 、 。
(4)实验中加入“Na2CO3溶液”的目的是 。
(5)利用提供的沉淀试剂,再写出一种添加试剂的操作顺序(填序号): 。
23.(9分)潍坊某化工厂以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠,其制备过程表示如下:
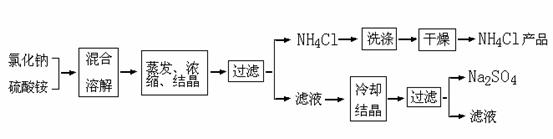
请回答:
⑴工业上生产的氯化铵属于 (填写序号)。
A.酸 B.碱 C.盐 D.氧气物
⑵在其它条件不变时,由下图可看出硫酸钠的溶解度与温度的关系为 。工业上从溶液中结晶析出氯化铵的温度范围约为 。
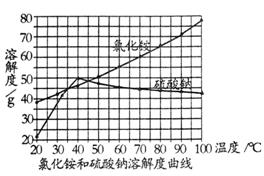
(3)设计实验验证硫酸钠中含有NH4C1: 。
22.(11分)海水中镁的含量一般为1.28g·L-1,总储量约为2×1015t某镁冶炼厂利用海水制镁,其工业流程如下:

根据上述流程图,回答下列问题:
(1)石灰窑中发生反应的化学方程式为 。
(2)消化池中发生的反应CaO +H2O=====Ca(OH)2,其反应类型为 ,
消化池中温度升高的原因是 。
(3)写出设备A、B和C中反应的化学方程式
A: ;
B: ;
C: 。
⑷氯气不能排放到空气中,而要循环使用,其原因是是:
①氯气有毒,排入空气会污染环境;
② 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com