
2.市场上销售的加碘食盐、含氟牙膏、高钙牛奶、补铁酱油等,这里的碘、氟、钙、铁是指
A.单质 B.分子 C.元素 D.原子
1.二氧化碳在下列变化中只发生物理变化的是
A.制汽水 B.制干冰
C.被石灰水吸收 D.参与植物的光合作用
41.⑴实验室常用过氧化氢与二氧化锰来制取氧气,该反应中二氧化锰的作用是 。
⑵实验室也可用高锰酸钾来制取氧气。某同学想用实验来证明高锰酸钾溶液的紫红色是MnO4-的颜色,而不是K+的颜色,他设计的下列实验步骤中没有意义的是 。
①将高锰酸钾晶体加热分解,所得固体质量减少
②观察氯化钾溶液没有颜色,表明溶液中K+无色
③在氯化钾溶液中加入适量锌粉振荡,静置后未见明显变化,表明锌与K+不反应
④在高锰酸钾溶液中加入适量锌粉振荡,静置后见紫红色褪去,表明MnO4-为紫红色
⑶过氧化钠与水的反应也能用来制取氧气:
Na2O2+2H2O=2NaOH+H2O2
2H2O2=2H2O+O2↑
已知:当NaOH溶液的质量分数大于24%时,酚酞显无色;H2O2具有漂白性,能使有色有机物氧化褪色。
现将0.39g Na2O2溶解在10.0mL过量水中,再向所得溶液中滴入2滴酚酞,溶液先变红,片刻后红色褪去。据此回答下列问题:
①甲同学认为红色褪去的原因是由于溶液中NaOH的质量分数过大,此种说法________(填“正确”或“不正确”)。请通过计算加以说明。(假设过氧化氢完全分解;水的密度为1 g/cm3)
②乙同学认为红色褪去的原因是由于反应后的溶液中有过氧化氢存在。请设计实验加以证明。
40.实验室常用氯化铵固体与碱石灰固体共热来制取氨气。常温下NH3是一种无色、有刺激性气味的气体,密度比空气小。NH3极易溶于水,其水溶液呈碱性。
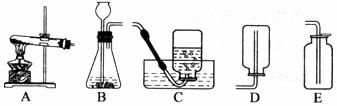
⑴现选择合适的装置来制取并收集NH3,应该选择的发生装置是 ,收集装置是_________。
⑵ 若用湿润的红色石蕊试纸来检验NH3,产生的现象是 。
⑶工业上采用氨氧化法制硝酸,该工业生产的第一步反应为4NH3+5O2  4X+6H2O,则X的化学式为___________。
4X+6H2O,则X的化学式为___________。
39.在实验室配制溶液时,常涉及以下过程:①溶解②称量③计算④装瓶存放。请按要求回答问题:
⑴现欲配制50g 5%氯化钠溶液,配制过程的先后顺序是 (填序号)。
⑵用已调节平衡的天平称取氯化钠固体时,发现指针偏右,接下来的操作是 。
⑶在量取蒸馏水体积时,若仰视读数,则会导致氯化钠溶液的溶质质量分数 (填“<”或“>”)5%。
⑷在溶解步骤中需要的仪器有 、 。
38.利用海水可以制备金属单质,其流程如下图所示:
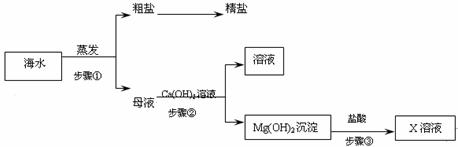
⑴实验室将粗盐制成精盐的过程中,常采用 操作把不溶性杂质除去。
⑵步骤③中涉及的化学反应方程式为 。
⑶通过以下步骤可以制取金属Y:

步骤④中涉及的化学反应方程式为 ;该反应的类型为 。
37.下表为某品牌燕麦片标签中的一部分:
|
营养成分 (每100 g含有) |
蛋白质 |
糖类 |
油脂 |
钙 |
铁 |
|
7.4g |
7.8 g |
7.9 g |
206 mg |
19.2 mg |
|
|
钠 |
锌 |
维生素C |
|
|
|
|
37.8 mg |
10.1 mg |
18 mg |
|
|
|
⑴燕麦片中能为人体提供能量的营养素有 ;
⑵燕麦片中含有 种人体所需的微量元素;
⑶人体健康离不开钙元素。下列有关钙元素的叙述中,不正确的是(填序号) ;
①人体中钙元素大部分存在于骨骼和牙齿中
②幼儿及青少年缺钙会得佝偻病和发育不良
③老年人缺钙会发生骨质疏松,容易骨折
④成年人比幼儿和青少年需要摄入更多的钙
⑷钙片的有效成分是碳酸钙,虽然碳酸钙难溶于水,但服用后可转化为可溶性钙盐被人体吸收,其原因是 (用化学方程式表示);为了提高补钙效果,服用钙片时常需配合服用维生素D,据此可推知维生素D的功能是 。
⑸现有下列食物:①大米②豆油③鱼④鸡蛋⑤青菜⑥西瓜。其中能提供丰富蛋白质的有 。
27.(6分)我市有丰富的NaCl矿产资源,NaCl是一种重要的化工原料,可以用于生产烧碱、氯气等重要的化工产品。某化工厂购进一批以NaCl为主要成分的原料(假设杂质全部为CaCl2),化验员欲测定原料中NaCl的质量分数,先称取60.0g样品,加足量水充分溶解后,向所得溶液中加入足量的溶质质量分数为10%的Na2CO3溶液,充分反应后,生成2.0g白色沉淀。(已知:CaCl2+Na2CO3===2NaCl+CaCO3↓)
试回答下列问题(写出计算过程):
(1)原料中NaCl的质量分数是多少?
(2)当恰好完全反应时,需Na2CO3溶液的质量是多少?
26.(7分)牙膏是日常生活中的必需品,它通常由磨擦剂、发泡剂、粘合剂等组成。磨擦剂是牙膏的主要成分,约占牙膏质量的一半以上。为了测定一种以碳酸钙为磨擦剂的牙膏中碳酸钙的含量,同学们根据碳酸钙的性质设计了以下三种不同的方案(除碳酸钙外,这种牙膏中的其它物质不与盐酸反应生成气体,且均溶于水):
方案一:将一定量的牙膏放入水中充分搅拌,然后进行 X 、洗涤、干燥等操作,称量出不溶物的质量,再计算出碳酸钙的质量分数。
方案二:将一定量的牙膏与过量的盐酸反应,用图1所示装置(装置的气密性良好),测量
二氧化碳气体的体积(锥形瓶中液面高度变化忽略不计),利用该条件下二氧化碳的密度,计算二氧化碳的质量,然后根据化学方程式求出碳酸钙的质量,再计算出碳酸钙的质量分数。
方案三:用图2所示装置,将一定量的牙膏与过量的盐酸反应,测量相关数据,推算出二氧化碳气体的质量,然后根据化学方程式求出碳酸钙的质量,再计算出碳酸钙的质量分数。
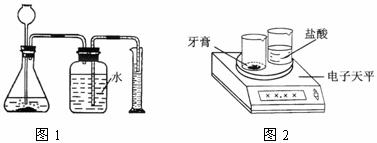
老师针对三种方案提供了所需的仪器用品,同学们进行分组实验。实验中,同学们操作规范、计算无误。
按照要求回答下列问题:
(1)方案一中操作X是 ,按照方案一进行实验的同学在规定时间内没有来得及完成实验,请写出可能的原因 、
(任写两条)
(2)碳酸钙和盐酸反应的化学方程式是
方案二中实验结果偏低,写出一条可能的原因: ,
你的改进方案是: 。
(3)方案三中实验结果偏高,原因可能是: 。
25.(3分)某同学在实验室帮助老师准备实验的时候,看到一试剂瓶(如下图所示)。于是他猜想:乙醇含有“氢氧根”,所以它的水溶液应该显碱性。在老师的鼓励下,该同学通过实验,发现了自己的猜想是错误的。请你填写下表:
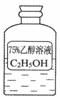
|
实验步骤 |
观察到的现象 |
结 论 |
|
|
|
乙醇溶液不显碱性 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com