
5.某课外活动小组通过Internet网上资料得知:废弃的定影液中含有一定量的AgNO3。他们从摄影店收集到一些废弃的定影液,准备将其中的银以单质的形式全部回收。于是进行了以下的实验活动。
(1)[设计方案]:①加入比银活泼的金属单质 ②除去金属混合物中的杂质
(2)[小组讨论]:
①选择加入的金属:
甲同学认为:向定影液中加入过量铜粉,则得到的金属混合物中含银和铜。
乙同学认为:向定影液中加人过量铁粉,则得到的金属混合物中含银和铁。
你认为__________同学的方案更合理,该方案的化学方程式为______________。
②在这种方案中除去银粉中过量金属的方法:
向金属混合物中加入适量的试剂__________,化学方程式为________________。
(3)[进行试验]过程如下:
①废弃的定影液 混合物+溶液A
混合物+溶液A
②金属混合 物溶液B
物溶液B
请问操作a是__________,需要用到的玻璃仪器有:烧杯、玻璃棒、__________;
(4)[产品验证]:请你设计一种简单方法验证得到的银中是否还含有铁粉,方法是________________________________________。
4.已知A、B是常见的碱,甲、乙是常见的盐,C是一种常见的无色无味的气体。这几种物质间的转化关系如下图所示。请回答:
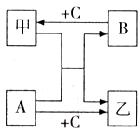
(1)下列物质的化学式:甲__________,乙__________;
(2)写出甲与A反应的化学方程式__________________________;该反应的基本类型属于__________;
(3)若要测定B溶液酸碱度的大小,应选择(填序号)__________。
①pH试纸 ②石蕊试液 ③酚酞试液
3.某元素的原子结构示意图为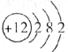 ,则该元素的两个原子可表示为_________,该元素的阳离子与
,则该元素的两个原子可表示为_________,该元素的阳离子与 结合形成的化合物的化学式为_________。
结合形成的化合物的化学式为_________。
2.燃料的燃烧在人类社会的发展过程中起着相当重要的作用。从环境保护的角度考虑,在煤气、沼气和氢气中,首选的燃料是_________;近年来,我市农村大力推广使用沼气,沼气的主要成分是_________;煤气的主要成分是CO,其燃烧的化学方程式为_________ ___________________________。
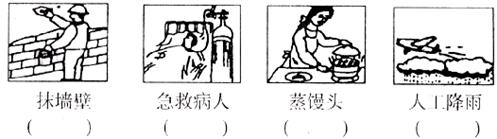
1.氧气、干冰、熟石灰和纯碱四种物质分别与下列图中的人类活动有关,请将他们的化学式填在图下相应的括号内。
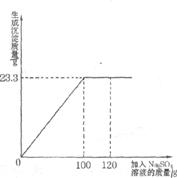
26.(9分)将29.1g由NaCl和BaCl2组成的固体混合物溶解于94.2mL水中( =1g/cm3),向所得溶液中滴加质量分数为14.2%的Na2SO4溶液,至恰好完全反应。下图是所加Na2SO4溶液质量与生成沉淀质量的关系图,计算:
=1g/cm3),向所得溶液中滴加质量分数为14.2%的Na2SO4溶液,至恰好完全反应。下图是所加Na2SO4溶液质量与生成沉淀质量的关系图,计算:
(1)生成沉淀的质量是多少?(2)所得溶液中溶质的质量分数为多少?
25.(9分)小强在回家的途中经过一鱼塘边时,发现养鱼师傅向鱼塘中撒一种微黄色的固体,鱼塘中顿时产生大量气泡,经咨询得知,这种固体的主要成分是过氧化钙(CaO2),请你与小强共同探究。
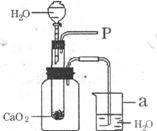
(1)为研究鱼塘中大量气泡是何种气体所致,小强使用如图所示的装置进行实验,打开分液漏斗的活塞,控制滴加水的速度,观察到试管内有气泡产生,用带火星的木条靠近P处,木条复燃,说明生成的气体是___________。由此可知养鱼师傅向鱼塘中撒过氧化钙的目的是___________,仪器a的名称是___________。
(2)根据质量守恒定律,小强认为过氧化钙与过量水反应还应产生某种含有钙元素的产物。开始小强假设该产物为CaO,但通过思考他很快否定了原先的假设,并重新假设生成的含钙产物为Ca(OH)2。请解释小强否定原假设建立新假设的理由:____________________
_________________________________
请设计一个实验方案来验证小强的新假设,并填入下表空格中:
|
实验步骤 |
可能出现的现象 |
结论 |
|
|
|
CaO2与H2O反应有Ca(OH)2生成 |
|
|
CaO2与H2O反应无Ca(OH)2生成 |
(3)小强通过实验证明了过氧化钙与水反应的确有氢氧化钙生成,请写出过氧化钙和水反应的化学方程式:_________________________
(4)小强在实验时观察到烧杯中有气泡产生,由此他还得出了什么结论_______________
____________________________。
24.(11分)镁合金的强度高、机械性能好。这些特性使金属镁成为制造汽车、飞机、火箭的重要材料,从而获得“国防金属”的美誉。海水提镁是国际上的主要趋势,工业流程图如下;

其步骤为:
Ⅰ.将海边大量存在的贝壳(主要成分为CaCO3)煅烧成生石灰,并将生石灰制成石灰乳
Ⅱ.将石灰乳加入到海水反应池中,经过沉降、过滤得到Mg(OH)2沉淀
Ⅲ.在Mg(OH)2沉淀中加入盐酸中和得到MgCl2溶液,再经蒸发结晶得到MgCl2·6H2O
Ⅳ.将MgCl2·6H2O在一定条件下加热得到无水MgCl2
V.电解熔融的无水MgCl2可得到Mg
(1)请根据上述步骤回答问题:
①写出步骤Ⅰ、Ⅲ的有关化学方程式:
Ⅰ.贝壳煅烧成生石灰________________________________
Ⅲ.Mg(OH)2沉淀中加入盐酸中和________________________________
②步骤Ⅰ-Ⅴ中有分解反应的是(填写步骤序号):_______________
③步骤Ⅲ中的蒸发是利用风吹日晒来完成的,而在实验室中进行蒸发操作需要的主要仪器有____________、_____________、酒精灯、带铁圈的铁架台、坩埚钳等。
④上述海水提镁的流程中,采取了哪些措施来降低成本、减少污染的?请写出其中一点:
___________________________________________
(2)回答下列问题;
①右图为镁元素的某种粒子结构示意图,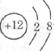 该图表示(填序号)___________。
该图表示(填序号)___________。
A.分子 B.原子 C.阳离子 D.阴离子
②镁原子在化学反应中容易失去电子,镁是一种(填“活泼”或“不活泼”)__________金属,除了能与氧气反应,还可以与氮气,二氧化碳等反应。
(3)为测定约含镁30%的镁铝合金(不含其它元素)中镁的质量分数。
①第一小组设计下列实验方案:称量 g镁铝合金粉末,放在如图所示装置的惰性电热板上,通电使其充分灼烧。
g镁铝合金粉末,放在如图所示装置的惰性电热板上,通电使其充分灼烧。
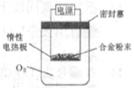
讨论一:欲计算镁的质量分数,该实验中还需测定的一种数据是____________。
讨论二:若用空气代替O2进行实验,对测定结果_________(填“有”或“无”)影响。
②第二小组设计下列实验方案:称取bg镁铝合金,与足量的稀盐酸完全反应。
欲计算镁的质量分数,该实验中还需测定的一种数据是________________
23.(4分)构建知识网络是一种重要的学习方法。下图是关于盐酸化学性质的知识网络,“_____________”表示相连的两种物质能发生反应,“→”表示一种物质转化成另一种物质,A、C属于不同类别的化合物。完善这个知识网络:
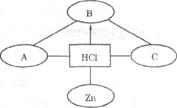
(1)写出A、B、C的化学式:
A________________;B________________;C_______________。
(2)根据自己得出的知识网络写出一个复分解反应化学方程式:_____________________
22.(4分)下图是甲、乙两种固体物质的溶解度曲线,试回答下列相关问题。

(1)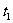 ℃时,100g水中溶解20g甲,溶液刚好饱和;那么,50g水中溶解_______g乙,溶液达到饱和。
℃时,100g水中溶解20g甲,溶液刚好饱和;那么,50g水中溶解_______g乙,溶液达到饱和。
(2)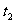 ℃时,比较两物质的溶解度大小____________。
℃时,比较两物质的溶解度大小____________。
(3)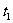 ℃时,若要将甲物质的饱和溶液变为不饱和溶液,可采用的方法是____________(写出一种即可)。
℃时,若要将甲物质的饱和溶液变为不饱和溶液,可采用的方法是____________(写出一种即可)。
(4)若要从甲中含有少量乙的混合溶液中提纯甲,可用的方法是_______________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com