
26.(2分)碳酸氢铵是农业生产上常用的一种氮肥。下图是某化肥厂生产的碳酸氢铵化肥包装袋上标签的部分文字。请你通过

计算填写下列空白:
(1)碳酸氢铵中氮、氢、碳、氧元素的质量比为 ;
(2)这种化肥实际含碳酸氢铵的质量分数为 (结果精确到0.1%)。
25.(9分)暑假,同学们在帮忙老师整理实验室时,发现一瓶石灰水试剂瓶瓶壁和瓶塞周围有一些白色粉末。为了弄清楚白色粉末的成分及形成原因,他们进行了如下探究:
(1)对白色粉末成分的猜想和成因分析:
|
白色粉末的成分 |
形成的原因 |
|
可能是CaCO3 |
石灰水与空气中CO2反应 化学方程式为: |
|
可能是
|
暑假气温较高,溶质的溶解度降低或溶剂蒸发,石灰水中的溶质结晶析出 |
经过反复思考,同学们认为白色粉末还可能是 的混合物。
(2)设计实验:
甲同学取白色粉末装入试管中,加入少量的水、振荡,发现有白色固体不溶解。于是他得出粉末中一定有CaCO3的结论。乙同学查阅了溶解性表(如下表),认为甲同学的结论不严密,理由是: 。
|
|
OH- |
Cl- |
CO32- |
NO3- |
|
Ca2+ |
微 |
溶 |
不 |
溶 |
为了得出较严密的结论,他们进行了如下实验,请完成下列实验报告:
|
实验步骤 |
可能观察到的现象 |
结论 |
|
取上述试管中的上层清液,滴加1-2无色酚酞试液 |
|
|
|
往上述试管中的残留的固体中加入稀盐酸 |
|
白色粉末中 (选填“有”或“无”)CaCO3 |
|
由上述实验可知白色粉末的成分是:
。 |
24.(5分)在实验室,小刚想用紫色石蕊试液鉴别稀硫酸、氢氧化钠和碳酸钠三瓶无色溶液。请你帮助他完成实验。
(1)首先被鉴别出来的一种溶液是 ,依据的现象是
。
(2)利用现有条件将另外两种溶液鉴别出来,填写下面的实验报告。
|
实验步骤 |
实验现象及结论 |
|
|
|
23.(6分)根据下列仪器,回答有关问题:
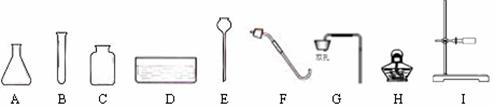
(1)上图A、B、C、D中能直接加热的仪器是 (填写仪器名称)。
(2)下图为小明组装的二氧化碳制取装置,装药品前首先进行的操作是 。
他认为该装置也可用于制取氧气,其制取氧气的化学方程式为_______ _。收集二氧化碳和氧气都可用的一种方法是 。

(3)小明拟选用仪器B、C、F、H再设计一套制取氧气的装置,他还需选用图中的仪器有________ _(填写仪器序号),该装置中所用的药品是______________(填写药品名称)。
22.(5分)A、B、C、D、E、F、G、H、I都是初中化学学过的物质。其中E、F、H均为黑色固体,B为紫红色固体,D为混合物。他们之间有下图的转化关系(部分生成物已省去)
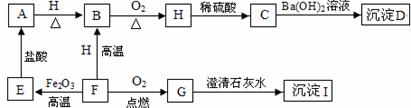
(1)用化学式表示D的组成: __________________、___________________。
(2)F→G的反应类型:_____________________。
(3)写出F→E的化学方程式:____________________________。
(4)指出B的一种用途: ___________________。
21.(4分)物质之间既相互联系,又存在规律,这是我们学好化学应该掌握的一种基本方法。请你仿照下表中示例,找出O2、CH4、CO2、NH3、C2H4(乙烯)五种气体之间存在的另外两个规律,并排列出顺序,将答案填在下表的空格内。
|
规律 |
排列顺序 |
|
示例:标准状况下,密度由小到大 |
CH4、NH3、C2H4、O2、CO2 |
|
(1) |
|
|
(2) |
|
20.(4分)写出下列反应的化学方程式:
(1)细铁丝在氧气中燃烧 ;
(2)用天然气作燃料 ;
(3)用氢氧化铝的药物治疗胃酸过多症 ;
(4)氯化铵(NH4Cl)与熟石灰混合研磨 。
19.(5分)金属在人们的生活、生产中有着广泛的应用。
(1)地壳中含量最高的金属元素是 ;
(2)日常使用的金属材料多数属于合金。下表列出了一些常见合金的主要成分和性能。
|
合 金 |
合金的主要性能 |
主要成分及纯金属的性能 |
|
焊 锡 |
熔点183 ℃ |
锡:熔点232 ℃;铅:熔点327 ℃ |
|
硬 铝 |
强度和硬度好 |
铝、铜、镁等。硬度小,质软 |
|
不锈钢 |
抗腐蚀性好 |
铁、铬、镍等。纯铁抗腐蚀性不如不锈钢 |
由上表推断,与组成合金的纯金属相比,合金的优点一般有(填序号) ;
①强度更低 ②硬度更高
③熔点更高 ④抗腐蚀性更好
(3)生活中的铁制品容易锈蚀。铁制品锈蚀的主要原因是 ;
(4)生活中的铝制品却不易锈蚀,原因是 ;
(5)提出下列保护金属资源的建议,其中合理的是 (填字母)。
①防止金属制品腐蚀 ②回收利用废旧金属制品
③提倡大力开采金属矿石资源以满足需要 ④开发使用金属代用品
18.实验台上提供了铁丝、锌片、铜片、稀盐酸、硫酸铜溶液、硝酸银溶液6种药品。为探究金属的活动性顺序,小红同学利用上述药品进行了如下的实验:
实验一:将锌片与铜片分别放入稀盐酸中,锌片表面有气泡产生,铜片无明显变化;
实验二:将铁丝放入硫酸铜溶液中,铁丝表面有红色物质生成;
实验三:将铜片放入硝酸银溶液中,铜片表面有银白色物质生成。
(1)小红的上述实验可得出的金属活动性关系是______________________________;
(2)要确定铁、锌、铜、银四种金属的活动性顺序,小红还应补充的实验是
______ _ _(利用现有条件)。
17.对于稀硫酸而言,溶质的质量分数越大,溶液的酸性越强。常温下,10%的稀硫酸的
pH________(填“大于”、“小于”或“等于”)2%的稀硫酸的pH。如果要使稀硫酸的pH升高,你采取的方法有:
(1)不发生化学反应的方法:_____________________________;
(2)利用化学反应的方法可有多种,请你任选两种方法(只要求写出所加物质的名称
或化学式,且要求所选两种方法所用的物质的类别不同):_______ ___、___ __ ____。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com