
3.根据学过的知识判断下列做法不可能的是( )。
A.可用铅笔芯粉末打开锈锁 B.汽车使用乙醇汽油能减少污染
C.用食醋区分食盐和纯碱两种粉末 D.油锅着火,应用水浇灭
2.下列化学符号正确的是( )。
A.一个一氧化碳分子:Co B.2个碳酸根离子:2CO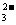
C.3个亚铁离子:3Fe3+ D.2个氢原子:2H2
1.下列物质的变化与空气成分无关的是( )。
A.苛性钠在空气中变质 B.浓盐酸露置在空气中质量变轻
C.生石灰在空气中变质 D.酥脆的饼干放置在空气中变软
35.(4分)甲、乙、丙三位同学用下列试剂分别进行实验,均恰好完全反应,有关实验数据如下表:
|
|
所用试剂及质量 |
反应后所得溶液质量 |
|
甲 |
CaO(固) a1 g
, 10%的盐酸 b1 g |
c1 g |
|
乙 |
Ca(OH)2(固) a2 g , 10%的盐酸 b2 g |
c2 g |
|
丙 |
CaCO3 (固)a3 g
,10%的盐酸 b3 g |
c3 g |
已知:a1+a2+a3=16.5g, b1+b2+b3=146g
现将甲、乙、丙三位同学反应后所得的溶液全部倒入一个容器内,称得此溶液质量为158.1g。试求:
(1)参加反应的碳酸钙固体的质量。(写出计算过程)
(2)反应后所得溶液中溶质的质量分数是 %。
(3)反应过程中共生成水的质量是 g。
34.(2分)人体胃酸过多会引起胃病。下图为某抗酸药标签上的部分文字,
请回答下列问题:

(1)氢氧化镁中镁元素与氧元素的质量比为________。
(2)每片药片中含镁元素的质量为________mg。
33.(7分)某校化学兴趣小组的同学在探究金属的化学性质时,发现铜与稀硫酸在常温或加热的条件下均不反应。那么,铜与浓硫酸能否发生反应呢?他们设计了如下图所示装置进行探究。
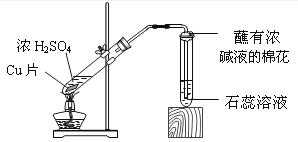
[猜想与假设]
①在常温下能反应
②常温下不能反应,但在加热条件下能反应
③在加热条件下不能反应
[查阅资料]
含有Cu2+的水溶液通常显蓝色
[实验与事实]
操作① 将一小块铜片放入试管中,加入足量浓硫酸,无明显现象;
操作② 加热该试管,铜片上有气泡,产生了有刺激性气味的气体;
操作③ 停止加热,将试管中的残液慢慢倒入水中,溶液呈蓝色。
[分析与思考]
⑴甲同学认为,由以上探究可知:猜想 (填序号)是正确的。
⑵乙同学认为,经检验产生的气体是SO2,所以铜跟浓硫酸在加热条件下反应的产物只是SO2和CuSO4。
⑶丙同学认为,在实验装置中,“蘸有浓碱液棉花”的作用是 。
[反思与评价]
⑷操作③中,从安全角度考虑 (填“可以”或“不可以”)将水倒入残液中,其理由是 。
⑸在[分析与思考]⑵中对产物只是SO2和CuSO4的判断是否准确 (填“是”或“否”),其理由是 。
[拓展与应用]
根据以上探究和已掌握的知识,该兴趣小组的同学设计了两个制取硫酸铜的实验方案:
① Cu CuSO4
CuSO4
② Cu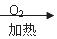 CuO
CuO 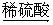 CuSO4
CuSO4
⑹经过对两种方案的讨论、对比,同学们认为方案②具有的优点有 (填序号),所以工业上制备硫酸铜不是直接利用浓硫酸与铜反应。
A.提高铜的利用率 B.提高硫酸的利用率
C.不产生污染大气的SO2 D.不用浓硫酸,安全性好
32.(7分)某纯碱样品中含有少量氯化钠杂质,现用下图所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等在图中均已略去)。
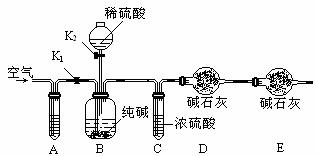
实验步骤如下:
①按图连接装置,并检查气密性;
②准确称得盛有碱石灰(固体氢氧化钠和生石灰的混合物)的干燥管D的质量为83.4g;
③准确称得6g纯碱样品并放入容器B中;
④关上K1,打开K2,缓缓滴入稀硫酸,至不再产生气泡为止;
⑤关上K2, 打开K1,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的总质量为85.6g。
试回答:
(1)已知装置A中试剂为碱性溶液,其作用是 。
(2)实验步骤⑤鼓入空气的目的是______。
(3)C装置的作用是 ,若没有C装置,则会导致测定结果 _ __ (填“偏大”或“偏小”) 。
(4)E装置的作用是______。
(5)根据实验中测得的有关数据,计算出纯碱样品碳酸钠的质量分数为____ _%(计算结果保留一位小数)。
(6)经精确测定,样品中碳酸钠的实际质量分数略小于上述所求数值,其原因可能是 。
31.(5分)在化学实验操作测试课上,小明同学利用以下仪器和药品进行气体的制取及性质实验。请回答:
(1)指出图中仪器a的名称_______。
(2)由实验台上提供的仪器和药品,小明可以制备气体的原理是(用化学方程式表示) 。
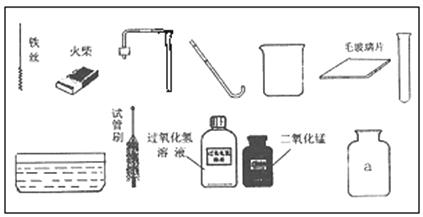
(3)下面是小明完成实验的主要操作示意图:
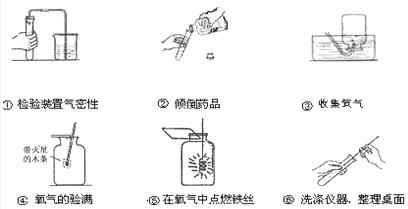
按测试评分标准,每项操作正确得l分,满分6分,实验完毕后小明得了3分。他失分的操作有 (填写序号),说明其原因(写出其中一项原因即可) 。
(4)仅用(2)中仪器(药品另选),小明还能制取另一种可用向上排气法收集的常见气体。检验该气体的方法是 (用化学方程式表示)。
30.(6分) 下列A~H八种物质都与人类生产、生活密切相关。已知A、G、H均为常见的单质,E为难溶于水的白色沉淀。其转化关系如下图所示(部分反应物或生成物已略去),
试回答:
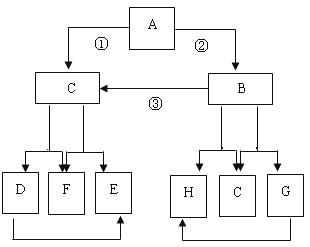
⑴写出A与E的化学式:A ,E 。
⑵写出D→E的化学方程式 。
⑶写出G→H的化学方程式 。
⑷图中反应①、②、③的共同反应物有 (写名称),且该物质可以与一种被认为是最清洁的燃料反应转化为F,此反应的化学方程式为 。
29.(5分)下列图像表示盐酸和氢氧化钠溶液发生反应过程中溶液的pH变化。请从图像中获取信息,回答下列问题:
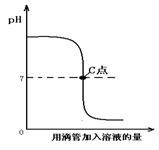
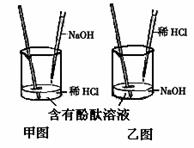
(1)进行该反应的实验操作是按照以上 (填甲或乙)图所示进行,烧杯中溶液的颜色变化是 。
(2)所发生的中和反应的化学方程式为 。
(3)曲线上C点表示 。
(4)用溶质的质量分数为36.5%的盐酸40g与足量氢氧化钠溶液恰好完全反应,需要溶质的质量分数为20%的氢氧化钠溶液 g。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com