

22.100 t含80%的赤铁矿石能冶炼出含杂质3%的生铁多少吨?
21.同学们一起探究铝、铁、铜三种金属的活动性,小刚同学设计了用铜丝、铁丝、铝丝和稀盐酸,只用一只试管,取一次盐酸的探究方案。请你和他们一起完善下表的探究方案并回答有关问题。
(1)填表
|
实验步骤 |
观察到的现象 |
|
①在试管中取少量盐酸,插入铁丝,充分作用。 |
|
|
②在①所得的溶液中,插入 ,充分作用。 |
无明显现象 |
|
③在②所得的溶液中插入 ,充分作用。 |
|
结论:金属活动性Al > Fe > Cu
(2)小华同学认为在小刚设计的方案中,只要补充一个实验,就可得出Al > Fe > H >Cu的结论。小华要补充的实验是 ;
(3)小强同学认为要得到Al > Fe > H >Cu的结论,不必做补充实验,中需将小明同学方案中插入金属的顺序调整即可,你认为调整后插入金属的顺序是 。
20.有位同学设计了下列实验(装置及所用药品如图所示),仔细观察后回答下列问题。
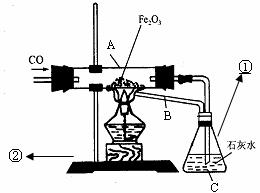
(1)写出图中标有序号的仪器名称①_______②_________
(2)在给氧化铁加热时,要先通入一氧化碳气体后加热,其目的是 。
(3)在C处看到的现象是 ,反应的化学方程式________________。
(4)本实验设计中,在B处所采取措施的目的是 ,其优点是
19.在Cu(NO3)2、AgNO3的混合溶液中,加入一定量的锌粉,充分反应后,可能有下列情况:
(1)若反应后锌有剩余,则此时反应后的混合物过滤,滤纸上留有的残留物是 ;滤液中存在 。
(2)若将反应后的混合物过滤,向所得的固体物质中滴加稀盐酸,没有气泡产生,则固体物质中一定有 ,可能有 。
18.为了探究影响金属与酸反应程度的因素,进行了以下实验:
|
实验序号 |
实验过程 |
实验现象 |
|
1 |
镁粉和铁粉分别与5%盐酸反应 |
镁粉产生气体快 |
|
2 |
铁粉和铁片分别与10%盐酸反应 |
铁粉产生气体快 |
|
3 |
铁片分别与5%盐酸和10%盐酸反应 |
10%盐酸产生气体快 |
由此得出影响金属与酸反应剧烈程度的因素有:
因素一:____________________________________________________;
因素二:_____________________________________________;
因素三:___________________________________________。
17.下列有三种制取硝酸铜的方案:
方案一:Cu + 4HNO3(浓) = Cu(NO3) + 2NO2↑+ 2H2O
方案二:3Cu + 8HNO3(稀) = 3Cu(NO3) + 2NO↑+ 4H2O
方案三:2Cu + O2 + 4HNO3(稀) = 2Cu(NO3)2 + 2H2O
请你从经济、环保的角度分析考虑选择一种最适宜的方案 ,你选择方案而不选其它方案的理由是(写两点): 。
16.构建知识网络是一种重要的学习方法。下图是关于铁化学性质的知识网络(“→”表示一种物质转化为另一种物质),其中B是密度最小的气体,C为红色固体单质。请回答下列问题:
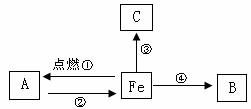
(1)A物质的化学式为 。
(2)B物质的一种用途是 。
(3)反应②还需要的一种反应物是 (填化学式)。
(4)写出反应③的方程式,并注明基本反应类型: ( )。
15.颗粒大小达到纳米级的单质铁具有很强的反应活性,俗称“纳米铁”。在高温条件下,用H2与FeCl2反应,可生成“纳米铁”和一种溶于水显强酸性的气体,写出该反应的化学方程式 。
14.生铁和钢都是铁的合金,它们的区别主要是 。
13.烧菜用的铁锅,主要是利用铁的________性质;铁锅长期在_____________中易生锈,铁锈的主要成分中铁呈 价。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com