
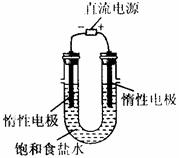
24.(10分)某学生试图用电解法根据电极上析出的物质的质量来验证阿伏加德罗常数,其实验方案的要点为:①用直流电电解氯化铜溶液,所以仪器如图;②在电流强度为IA,通电时间为ts后,精确测得电极上析出的铜的质量为mg。试回答:
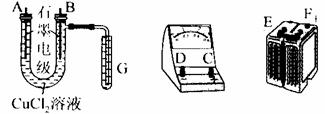
(1)如上,连接这些仪器的正确顺序为(用图中标注仪器接线柱的英文字母表示。下同
E接________________C接______________________,________________接F。
实验线路中的电流方向为_______→________→_________→C→________→________
(2)写出B电极上发生反应的离子方程式是_____________。(选填下列操作步骤的编号)
①称量电解前的电极质量 ②刮下电解后的电极上的铜并清洗 ③用蒸馏水清洗电解后的电极 ④低温烘干电极后称量 ⑤低温烘干刮下的铜后称量 ⑥再次低温烘干后称量至恒重
(4)已知电子的电量为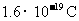 。试列出阿伏加德罗常数的计算表达式:NA=_______。
。试列出阿伏加德罗常数的计算表达式:NA=_______。
23.(6分)铁元素是最重要的过渡元素,钢铁在国民经济中起着举足轻重的作用。试回答下列问题:
(1)铁能溶解在FeCl3溶液中,该反应的离子方程式为_______________________。
若利用上述反应设计一个原电池,写出该原电池的电极反应:负极_______________,正 极__________________。
(2)烧过菜的铁锅未及时洗涤,第二天便出现红棕色锈斑[可以看作为Fe(OH)3],钢铁生锈是由于发生了电化学腐蚀。钢铁发生电化学腐蚀的正极反应为_____________,形成锈斑[Fe(OH)3][由Fe(OH)2氧化得到]的化学方程式为___________________________ 。
(3)钢铁的防腐是一个重要的课题。现有三个均盛有海水的烧杯,分别插入①纯铁片、②表面破损的镀锡铁片、③表面破损的镀锌铁片,铁被腐蚀时由快到慢的顺序是__________。
22.(12分)铁及铁的化合物应用广泛,如FeCl3可用作催化剂,印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式_________________________
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。正极反应____________________,负极反应______________________。
(3)腐蚀铜板后的混合溶液后,若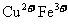 和
和
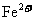 的浓度为
的浓度为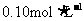 ,请参照下表给出的数据和药品,简述除去CuCl2溶液中的
,请参照下表给出的数据和药品,简述除去CuCl2溶液中的
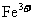 和
和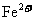 的实验步骤________。
的实验步骤________。
|
|
氢氧化物开始沉淀时的pH |
氢氧化物完全沉淀时的pH |
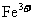 |
1.9 |
3.2 |
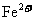 |
7.0 |
9.0 |
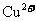 |
4.7 |
6.7 |
|
提供的药品:Cl2、浓H2SO4、NaOH溶液、CuO、Cu |
(4)某科研人员发现劣质不锈钢在酸中腐蚀缓慢,但在某些盐溶液中腐蚀现象明显,请从上表提供的药品中选择两种(水可任选),设计最佳实验,验证劣质不锈钢易被腐蚀。
有关反应的化学方程式:________________________________________________。
劣质不锈钢腐蚀的实验现象:_________________________________________________。
21.(5分)在东海油田开发过程中所用的-种新能源WF4燃料电池,以熔融的K2CO3,(其中不含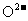 和
和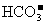 )为电解质,以东海油田中产生的石油气--丁烷为燃料气,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料作电极,已知负极的电极反应式为:
)为电解质,以东海油田中产生的石油气--丁烷为燃料气,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料作电极,已知负极的电极反应式为: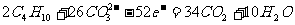 试回答下列问题:
试回答下列问题:
(1)该燃料电池正极的电极反应为___________________________________________。
(2)为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此必须在通入的空气中加入一种物质,这种物质是_________,它从哪里来?______________。
(3)写出燃料电池中电解质K2CO3在工作时的电离方程式__________________________。负极所生成的CO2能否和熔融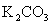 反应?_________________________________。
反应?_________________________________。
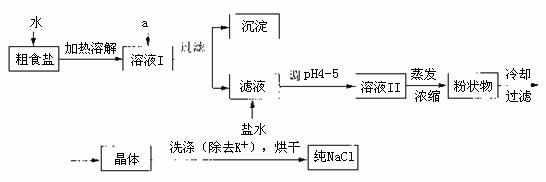
20.(10分)食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含有少量的K+、Ca2+、Mg2+、Fe3+、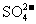 等杂质离子,实验室提纯NaCl的流程如图所示:
等杂质离子,实验室提纯NaCl的流程如图所示:
可提供的试剂:饱和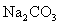 溶液,饱和
溶液,饱和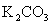 溶液,NaOH溶液、BaCl2溶液、Ba(OH)2溶液、75%乙醇、四氧化碳。
溶液,NaOH溶液、BaCl2溶液、Ba(OH)2溶液、75%乙醇、四氧化碳。
①欲除去溶液I中的Ca2+、Mg2+、Fe3+、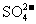 ,选出a代表的试剂,按滴加顺序依次为_________________(只填化学式)
,选出a代表的试剂,按滴加顺序依次为_________________(只填化学式)
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为_____________________。
(2)用提纯的NaCl配制500mL 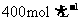 NaCl溶液,所用仪器除药匙、玻璃棒外还有_______(填仪器名称)
NaCl溶液,所用仪器除药匙、玻璃棒外还有_______(填仪器名称)
(3)电解饱和食盐水的装置如图所示,若收集到的H2为2L,则同样条件下收集的Cl2___________(填“>”“<”“=”)2L,原因是_____________,装置改进后,可用于NaOH溶液,若测定溶液中NaOH的浓度,常用的方法为________________________。
19.(6分)工业“从海水中提取镁”的流程图如图所示:
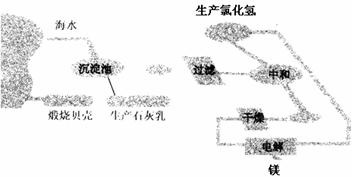
步骤为:①将海边大量存在的贝壳煅烧成石灰,并将石灰制成石灰乳;
②将石灰乳加入到海水沉淀池中经过滤得到Mg(OH)2沉淀;
③在Mg(OH)2沉淀中加入盐酸得到MgCl2溶液,再经蒸发结晶得到MgCl2·6H2O;
④将MgCl2·6H2O在一定条件下加热得到无水MgCl2;
⑤电解熔融的氯化镁可得到Mg。
请回答以下问题:
(1)步骤③中的蒸发是利用风吹日晒来完成的,而在实验室中进行蒸发操作需要的主要仪器有______、______、酒精灯、铁架台等。
(2)步骤④中的“一定条件”指的是_____________________________________,目的是________________________。
(3)上述提取镁的流程中,在降低成本、减少污染方面做了一些工作,请写出其中一点:______________________________
(4)有同学认为:步骤②后可加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁,这样可简化实验步骤,体现实验的简约性原则。你同意该同学的想法吗?为什么? 你的观点是_________________________。理由是___________________________________。
18.下列有关金属腐蚀与防护的说法正确的是( )
A.纯银器表面在空气中因化学腐蚀渐渐变暗
B.当镀锡的铁制品的镀层破损时,镀层仍能对铁制品起保护作用
C.在海轮外壳连接锌块保护外壳不受腐蚀采用了牺牲阳极的阴极保护法
D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀
第II卷(非选择题,共62分)
17.一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,其总反应为: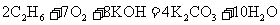 ,有关此电池的推断正确的是( )
,有关此电池的推断正确的是( )
A.正极反应为:
B.放电一段时间后,负极周围的pH升高
C.放电过程中KOH的物质的量浓度不变
D.每消耗1mol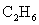 ,则电路上转移的电子数为14mol
,则电路上转移的电子数为14mol
16.天津是我国研发和生产锂离子电池的重要基地。锂离子电池正极材料是含锂的二氧化钴(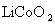 ),充电时,
),充电时,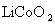 中Li被氧化,Li迁移并以原子形式嵌入电池负极材料碳(
中Li被氧化,Li迁移并以原子形式嵌入电池负极材料碳(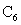 ),以原子形式嵌入电池负极材料碳(
),以原子形式嵌入电池负极材料碳(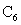 )中,以
)中,以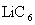 表示,电池反应为
表示,电池反应为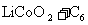
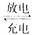
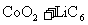 ,下列说法正确的是( )
,下列说法正确的是( )
A.充电时,电池的负极反应为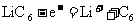
B.放电时,电池的正极反应为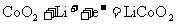
C.羧酸、醇等含活泼氢的有机物叮用作锂离子电池的电解质
D.锂离子电池的比能量(单位质量释放的能量)低
15.某同学按图所示的装置进行电解实验。下列说法正确的是( )
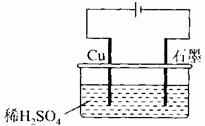
A.电解过程中,铜电极上有H2产生
B.电解初期,主反应方程式为:
C.电解一定时间后,石墨电极上有铜析出
D.整个电解过程中,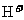 的浓度不断增大
的浓度不断增大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com