
36.某课外活动小组为了测定一批石灰石中碳酸钙的质量分数,将石灰石样品研成粉末,然后取一定量的石灰石粉末与过量稀盐酸充分反应(假设石灰石中的杂质既不和酸反应,也不溶于水),过滤、洗涤、干燥后称量滤渣质量的数据如下表:
|
实验序号 |
样品的质量/g |
滤渣的质量/g |
|
第一次 |
3.4 |
0.3 |
|
第二次 |
3.6 |
0.4 |
|
第三次 |
5.0 |
0.5 |
(1)该样品中碳酸钙质量分数的平均值为: (结果精确到0.1%)。
(2)引起三次实验数据差异的操作原因可能是: 。
(3)若利用题(1)的结果,煅烧100t这种石灰石,理论上最多能得到氧化钙多少吨?(结果精确到0.1t)
35.将0.5g二氧化锰与一定量氯酸钾共热到质量不减少为止,称得残渣质量为15.4g。求:(1)生成氧气多少克? (2)原先氯酸钾的质量是多少克?
34.早在17世纪,质量守恒定律被发现之前,英国化学家波义耳做过一个实验:在密闭的 玻璃容器中燃烧金属时,得到了金属灰,然后称量金属灰的质量,发现比原金属质量增加了。
(1)试解释金属灰质量比原金属质量增加的原因。
(2)由于波义耳称量方法上的原因,他错过了发现质量守恒定律的机会。请你改进他的称量方法,以验证质量守恒定律。
33.实验室常用于制取氧气的方法有:a、加热氯酸钾晶体和二氧化锰粉末;b、加热高锰酸钾固体;c、用二氧化锰粉末作催化剂使过氧化氢溶液分解产生水和氧气。
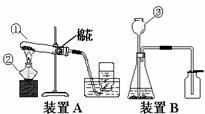
(1)请仔细分析装置A的特点,推测其所用的制氧气的方法是 (填a、b或c),写出这个反应的化学方程式 。
(2)采用方法c制取氧气应该选用装置 (填“A”或“B”)。写出这个反应的化学方程式 。
(3)利用装置A制氧气,在结束实验时要先撤离导管出水面,再熄灭酒精灯,其目的是 ;利用装置B制氧气时,仪器③的下端要插入液面以下,其目的是 。
31.配平下列化学方程式 (每1分,共6分)
⑴ NH3 + CI2 === N2 + NH4Cl
⑵ FeS2 + O2 === Fe2O3 + SO2
⑶ C3H8 + O2 === CO2 + H2O
⑷ N2O3 + Fe === Fe3O4 + N2
⑸ FeS2+ O2 === Fe2O3+ SO2
⑹ Al(OH)3+ H2SO4=== Al2(SO4)3+ H2O
30.有化学反应A+B=C+2D。已知49gA恰好与29gB完全反应,生成了60gC,则同时生成D__________g。现已知物质的相对分子质量:A为98,B为58,C为120,则D的相对分子质量__________。
29.我国古代炼丹术用的铅丹与硝酸反应的化学方程式是:
铅丹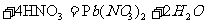 ,则铅丹的化学式为
。
,则铅丹的化学式为
。
28.将A、B两种物质各8 g,混合后加热使它们充分反应,反应结束后发现B全部用完,生成新物质C 3 g,D 9 g,则反应中A和B的质量比是 。
27.体育课上,剧烈运动后血液中产生了较多乳酸(C3H6O3),使人肌肉酸痛,经过一段时间放松,由于乳酸与吸入的氧气反应,生成二氧化碳和水,酸痛感消失。该反应的化学方程式为____________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com