
35.(3分)某校化学实验课上,同学们用化学方法探究一种钢样品中铁的含量。同学们将11.4 g钢样品和20.0 g稀盐酸(足量)放入质量为120.0 g烧杯中。在化学反应过程中对烧杯及其中的剩余物进行了四次称量,记录如下表:
|
反应时间 |
T0 |
T1 |
T2 |
T3 |
|
烧杯和药品质量/ g |
151.4 |
151.3 |
151.0 |
151.0 |
(最后结果保留一位小数)
(1)反应中产生氢气的质量是
g。
(2)钢的类型分为:
|
低碳钢 |
中碳钢 |
高碳钢 |
|
含碳量0.03%-0.3% |
含碳量0.3%-0.6% |
含碳量0.6%-2% |
假设残留在烧杯中的黑色固体全部是碳单质,试通过计算判断这种钢属于哪种类型的钢?
(3)某钢厂欲冶炼1000 t这种钢材,需含氧化铁80%的赤铁矿多少吨?
34.(3分)为测定一定质量某品牌果味VC含片中维生素C的质量,进行了如下实验。
(1)反应原理:C6H8O6 + I2 === C6H6O6 + 2X(I2不和VC含片中的其他成分反应),其中X的化学式是 。

(2)实验数据:取该VC含片2 g,使其跟I2反应,消耗2.54 g I2。请你参与计算,求出每片果味VC含片中维生素C的质量。(最后结果保留两位小数)
33.(6分)某研究性学习小组对炭粉与氧化铜反应产物中气体的成分进行研究。
[提出假设]该反应的气体产物中有二氧化碳和其他气体。
[查阅资料]氮气不能跟炭粉和氧化铜发生反应,也不跟石灰水反应,可用来隔绝氧气。
[设计方案]将一定量氧化铜在隔绝氧气的条件下与过量炭粉充分反应。通过测定反应前后相关物质的质量进行判断。
[进行实验]

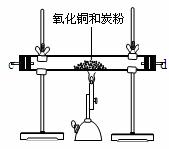

A B C
|
操作步骤 |
实验现象及分析 |
|
取1.6 g氧化铜与1 g炭粉均匀混合,放入质量为48.2 g的B装置的玻璃管中。 |
|
|
打开弹簧夹,往贮气瓶A中注入水,将氮气通入B装置中。 |
①水应从 端注入(填“a”或“b”)。 |
|
先通一段时间氮气。 |
②目的是 。 |
|
夹紧弹簧夹,用酒精喷灯加热玻璃管内的混合物。 |
③玻璃管中的现象是_____。 |
|
停止加热,再通入一段时间氮气。 |
④目的是 。 |
|
实验完毕后,冷却装置至室温,称得B玻璃管及固体总质量为50.2 g,称得C瓶中液体增重0.4 g。 |
⑤结论:原假设_____(填“成立”或“不成立”),理由是____(用计算式表示)。 |
32.(8分)小明同学为探究二氧化碳的性质,设计了下列实验。
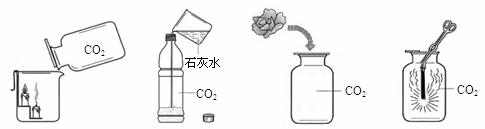
A B C D
(1)装置A中的实验现象是 ,说明CO2具有的性质是____。
(2)装置B中倒入适量澄清的石灰水后,迅速拧紧软塑料瓶的瓶盖并振荡,实验现象是 ,瓶内发生反应的化学方程式是 。
(3)取一朵用石蕊溶液染成紫色的干燥小花,将小花的一半用水喷湿,放入装置C中,可观察到的实验现象是 ,此现象说明CO2具有的化学性质是_____。
(4)小明在查阅资料时发现镁条能在CO2中燃烧,他在装置D中进行实验,发现镁条剧烈燃烧,发出白光,放热,产生一种白色固体和一种黑色固体,该反应中生成的白色固体是 。这个实验使你对燃烧条件产生的新认识是 。
31.(8分)实验课上,同学们利用如图所示装置进行气体制备。

(1)反应原理:实验室用高锰酸钾制氧气的化学方程式是 ,用大理石制二氧化碳的化学方程式是 。
(2)气体制备:二氧化碳的发生装置是 (填字母序号,下同)。
(3)气体收集:实验室收集O2的装置是 。
(4)气体验满:检验CO2是否收集满的方法是 。
(5)查阅资料:①相同条件下,氨气(NH3)的密度比空气小,且极易溶于水,其水溶液称为氨水。②加热氯化铵和氢氧化钙固体混合物可制得氨气。③氨气在加热的条件下能与氧化铜反应生成铜、水和空气中含量最多的气体。根据所查资料,制取氨气应选择的发生装置是 。若将收集满氨气的集气瓶倒扣在滴有无色酚酞的水中,可观察到的现象是 。请写出氨气和氧化铜反应的化学方程式 。
30.(5分)A、B、C、D、E、F及甲、乙、丙均为初中常见的物质,且甲、乙为气体。它们之间的关系如下图所示。(“→”表示转化关系,部分生成物及反应条件已略去)。

(1)若A为白色固体。
①写出下列物质的化学式:A ,甲 。
②写出F→E的化学方程式 。
(2)若A不是白色固体,将丙换为甲,其它物质均不变。
①写出A的化学式____。
②写出A→B+E的化学方程式 。
29.(5分)根据金属活动性顺序的相关知识,回答下列问题。
(1)将某金属M加入稀硫酸中,观察到金属M表面有气泡产生,M在金属活动性顺序表中的位置是在氢的_____。
(2)在相同条件下,把金属M及另外三种金属分别加入同浓度、等体积的稀硫酸中,观察反应产生气泡的剧烈程度,并记录如下(反应剧烈程度用“+”的多少表示):
|
金属 |
金属1 |
金属2 |
金属M |
金属3 |
|
反应剧烈程度 |
++++ |
+++ |
++ |
+ |
如果上述四种金属分别是Al、Mg、Fe、Zn,你认为金属M是 。
(3)铝和硫酸铜溶液反应的过程如下图所示:
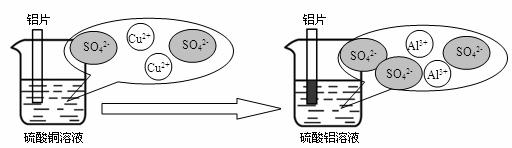
上述反应的化学方程式是 ,从微观粒子变化的角度分析铝片在硫酸铜溶液中发生的变化 。
(4)向硝酸银和硝酸铜的混合液中加入一些镁粉,充分反应后过滤。若向滤渣中滴加稀盐酸后没有气泡产生,则下列说法正确的是 (填字母序号)。
A.滤渣中可能含有铜,滤液中一定含有硝酸镁
B.滤渣中可能含有银,滤液中一定没有硝酸铜
C.滤渣中可能含有镁,滤液中可能含有硝酸银
D.滤渣中一定含有银,滤液中可能含有硝酸银
28.(6分)能源与环境已成为人们关注的热点。
(1)煤、石油、____属于化石燃料。要节约现有能源,还要开发新能源,如:地热能、核能、____(填一种即可)等。
(2)科学家预言,氢能源将成为21世纪的主要绿色能源,而水是自然界中广泛存在的物质,依据下图请你写出获取氢气的化学方程式 。
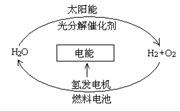
(3)含硫煤燃烧排放的SO2会引起“酸雨”现象。为减少大气污染,某发电厂采用了“石灰固硫法”,即向煤中掺入生石灰(CaO),在氧气参与反应和高温的条件下,用来吸收SO2,只生成硫酸钙,写出该反应的化学方程式 。
(4)“绿色化学”的特点之一是“零排放”。一定条件下,一氧化碳和氢气可以按照不同比例反应,若只生成一种产物就能实现“零排放”,符合这一要求的产物是 (填字母序号)。
A.甲醇(CH4O) B.甲醛(CH2O) C.乙醇(C2H6O) D.乙醛(C2H4O)
27.(5分)水是生命之源,人类的日常生活与工农业生产都离不开水。自然界中的水含有许多可溶性和不溶性杂质,通过多种途径可以使水得到不同程度的净化。
(1)下图是自来水厂净水过程示意图。在此过程中,净化水的方法主要有 (至少写三种)。
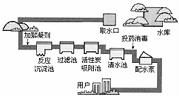
(2)硬水中含有较多可溶性钙、镁化合物,长期饮用硬水可能会引起体内结石。生活中常用 来区分软水与硬水。
(3)水中若含过量的氮、磷元素,会使藻类生长繁殖过快,导致水质恶化,发生“水华”现象。已知藻类主要含有C106H263O110N16P等物质,下列物质大量使用会导致“水华”现象的是 (填字母序号)。
A.向水中加入活性炭来净水
B.大量使用含Na5P3O10的洗衣粉
C.过量使用尿素[CO(NH2)2]等化学肥料
(4)双氧水是过氧化氢的水溶液。实验室所用的某过氧化氢溶液中,过氧化氢与水的质量比为1∶18,则该溶液中氢、氧元素的原子个数比是 。
26.(6分)从微粒角度认识物质,是学好化学的基础。
(1)构成物质的微粒有分子、原子和 。构成氯化钠的微粒是 。
(2)在玻璃杯中加入100 mL水,向水中放入一块冰糖,在杯子的外壁沿液面划一条水平线。过一会儿发现糖块消失了,液面比原来水平线降低了。请通过这一现象,推测分子具有的性质:① ;② 。
(3)用“ ”表示氢原子,“
”表示氢原子,“ ”表示氧原子,若它们构成的分子在一定条件下发生如下图所示的变化。
”表示氧原子,若它们构成的分子在一定条件下发生如下图所示的变化。

①下列关于该反应的说法中,不正确的是 (填字母序号)。
A.有氧化物生成 B.反应前后各种微粒的数目均没有改变
C.原子是化学反应中的最小微粒 D.这是一个分解反应
②从图中你还能获得的微观信息是 (答出一点即可)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com