
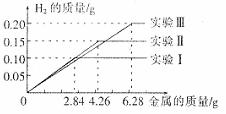
30.某化学调查小组的同学到钢铁厂做社会调查。他们抽取组成完全相同的质量为2.84g、4.26g、6.28g的三份钢样(假设钢样中只含铁和碳),分别加入100g稀硫酸中进行实验(实验Ⅰ、Ⅱ、Ⅲ),充分反应后,将得到的实验数据绘制出如下图像:
试回答(计算结果精确到0.1%):
(1)该钢样含铁的质量分数是______________________________。
(2)稀硫酸完全参加反应的实验中,反应后溶液中溶质的质量分数是多少。
29.(12分)甲同学在某食品包装袋内,发现有一个装有白色颗粒状固体A的小纸袋,上面写着“生石灰干燥剂,请勿食用”。甲同学随手将小纸袋拿出来放在空气中,经过一段较长的时间后,发现纸袋内的白色颗粒粘在一起成为块状同体B。请你与甲同学一起对块状固体B进行探究。
(1)猜想一:块状固体B中除氧化钙外还可能有:_______________、______________。
写出白色颗粒状固体A在空气中转化为块状固体B的化学反应方程式:
________________________________________、__________________________________ (2)猜想二:块状固体B溶于水可能有_______________现象(填“放热”或“吸热”)。
(3)取适量块状固体B加人盛有一定量水的试管中,振荡、静置、过滤,得到少量白色固体C。就白色固体C的成分,甲同学与乙同学进行了讨论。
甲同学认为白色固体C可能是:氢氧化钙;
乙同学认为白色固体C可能是:碳酸钙;
你认为白色固体C还可能是:______________________________。
请设计实验证明你的猜想(填写下表):
|
方 案 |
预期现象 |
相应结论 |
|
|
|
|
28.(11分)小明选择“铝丝和盐酸反应的快慢与什么因素有关”的课题开展探究。
下表是他分别用相同质量的铝丝和足量稀盐酸反应的三组实验数据:
|
实验编号 |
盐酸的质量分数/% |
反应温度/℃ |
铝丝消失的时间/S |
|
① |
3 |
20 |
500 |
|
② |
6 |
20 |
300 |
|
③ |
6 |
30 |
80 |
(1)写出铝和盐酸反应的化学方程式:__________________________________________。
(2)实验②和③表明:该反应快慢与______________________________有关。
(3)能表明盐酸浓度对反应快慢有影响的实验编号是:_______________。
(4)如果把实验①中盐酸的质量分数改为4%,请你推测出铝丝消失时间(用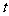 表示)的取值范围:____________________________________________________________
表示)的取值范围:____________________________________________________________
(5)该实验除了用铝丝消失的时间来衡量反应的快慢外,你还能提出新的方法来衡量该反应的快慢吗?方法: _______________________________________。
(6)小明将稀盐酸换成稀硫酸继续实验,发现铝丝和稀硫酸反应现象不明显。
[发现问题]为什么铝丝易与稀盐酸反应而难与稀硫酸反应呢?
[提出假设]C1-的存在使酸和铝的反应容易进行。
[设计实验]请你帮助小明设计一个合理的实验来验证假设
|
方 案 |
预期现象 |
相应结论 |
|
|
|
|
27.(8分)海洋是个巨大的资源宝库,它不仅孕育着无数的生命,还含有大量的化学物质。 Ⅰ.海水制溴。从海水中提取的溴约占世界溴产量的1/3,工业上常用“吹出法”制溴,其工艺流程如下:
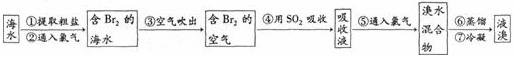
试回答:
(1)步骤②中的化学方程式为2NaBr+Cl2=2NaCl+Br2,其反应类型是_________________。
(2)非金属单质也具有类似金属与盐溶液之间的反应规律,如在溶液中可发生下列反应:Cl2+2KBr=2KCl+Br2 Br2+2KI=2KBr+I2,由此可判断C12、I2、Br2活动性由强到弱顺序是_____。
Ⅱ.食盐制碱。我国著名化学家侯德榜发明的联合制碱法的主要过程是:①向浓氨水中通入足量的二氧化碳生成碳酸氢铵溶液;②然后向溶液中加入食盐细粒充分搅拌,控制条件,利用物质的性质不同,两者发生反应生成碳酸氢钠。便有品体析出;③将析出的碳酸氢钠加热制得碳酸钠、二氧化碳和水。
四种盐在不同温度下的溶解度表:
|
|
10℃ |
20℃ |
30℃ |
40℃ |
50℃ |
|
氯化钠 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
|
碳酸氢铵 |
15.8 |
21.0 |
27.0 |
|
|
|
碳酸氢钠 |
8.1 |
9.6 |
11.1 |
12.7 |
|
|
氯化铵 |
33.3 |
37.2 |
41.4 |
45.8 |
50.4 |
请回答:
(3)过程①中发生反应的化学方程式_____________,该反应类型____________。
(4)根据溶解度表分析过程②中能发生反应的原因是______________________________,过程②发生的化学方程式______________________________该反应的类型为_______________。
(5)过程③中反应的化学方程式是_______________________________________________。
26.(6分)酸雨是天空降水呈酸性(pH小于5.6)的统称,个别地方酸雨的pH竟低于2.1(食醋的pH=3),可见其严重程度,形成酸雨的主要物质是大气中的SO2和氮氧化物。
(1)SO2,主要来源是煤和石油的燃烧,全世界每年有1.5亿吨SO2的排放量。SO2在空气中受阳光及尘埃等催化时可被氧化,生成三氧化硫,三氧化硫最终与雨水形成酸雨。试写出这一过程中所发生的两个化学反应方程式________________; _________________。
(2)酸雨可导致的危害有_______________(填编号)。
A.腐蚀建筑物 B.导致树木枯萎
C.造成洪涝灾害 D.影响农作物生长
(3)为了减少酸雨的形成,必须减少SO2的排放量,熟石灰的悬浊液、澄清石灰水、浓NaOH溶液都能吸收废气中的SO2,从净化效果、净化成本等方面综合考虑,你认为用_________比较合理。请用简要的文字说明理由。(理由2分)
25.(6分)某村根据资源特点将石灰石的开采、加工和高炉炼铁建在一起形成联产。
回答:
(1)炼铁的固体原料有铁矿石、焦炭和_______________。请写出炼铁过程中CO和FeO2,反应的化学方程式:____________________________________________________________。
(2)高炉炼铁排放的废气中含有大量的高温一氧化碳,可作为能源用来煅烧石灰石。
请写出煅烧石灰石的化学方程式:_____________________________________________。
(3)此联产方式的主要优点是______________________________(答出一点即可)。
(4)据CCTV报道,某钢铁有限公司即将报废的高炉重力除尘器顶部泄爆板爆破,造成煤气泄漏,导致2名操作工人当场死亡,另有15名事故抢险人员,因缺乏抢险知识而中毒死亡。煤气中毒实质是_______________中毒,你认为15名抢险人员死亡的原因是:______________________。
24.(3分)人的生活、生存与化学物质密切相关,请用化学知识解释。
(1)新鲜的鸡蛋随时都在进行呼吸作用,因其蛋壳(主要成分为CaCO3)表面有许多小孔而与外界进行气体交换,控制鸡蛋的呼吸作用可以延长鸡蛋的保鲜时间。小花发现妈妈买回鸡蛋后,把鸡蛋放在石灰水中蘸一下,妈妈说这样做可延长保鲜时间:这样做的理由有2个:一是______________________________,二是______________________________。
(2)人体内胃酸是由胃腺壁细胞分泌而来的,其生理功能是促进胃蛋白的催化作用,促使蛋白质的水解而被人体吸收、促使糖类物质进一步分解。但胃酸过多会使人体产生疾病、医疗上常用口服胃舒平(内含氢氧化铝)片的方法治疗胃酸过多,请用化学方程式表示其原理____。
23.(7分)小明同学学习了“酸的性质”、“金属”等知识后,对“酸与金属反应”的性质从内容、规律及其应用等方面进行了总结,请你协助小明同学完成相关总结材料
(1)酸与金属之间反应规律的文字表达式__________________________________________
(2)金属与酸之间的反应规律是__________________________________________________
请你用元素符号填写金属活动性顺序_______________________________________。
(3)金属与盐之间能否发生置换反应取决于参加反应的____________和____________,其反应规律是______________________________,该性质的实际应用实例是____________________
22.蛋白质是组成细胞的基础物质,没有蛋白质就没有生命。人体内的血红蛋白、各种酶都是蛋白质。一些可溶性的重金属盐(如Cu2+、Ba2+、Ag+等的可溶性盐)与蛋白质作用会使蛋白质凝固变性,从而丧失其生理功能危及生命。因此,可溶性重金属盐为有毒物质,根据上述所给知识,用化学式回答下列问题:
(1)CuSO4、AgNO3,、Ba(NO3)2、AgCl四种物质中,无毒的是_______________;
(2)在医疗上用X射线检查胃肠疾病时,让病人服用硫酸钡的悬浊液(俗称钡餐),而不能服用碳酸钡,其原因是人体胃液中含有一定量的_______________,与碳酸钡反应后,产生了一定量的使人中毒的氯化钡,其反应的化学方程式是______________________________。
(3)若因氯化钡中毒,下列方案中可作为最佳解毒措施的是_______________(填序号)。
A.多饮糖水 B.饮用纯碱溶液
C.饮用食盐水 D.饮用硫酸钠溶液
21.(6分)“从生活走进化学,从化学走向社会”。请你用化学知识解释以下生活中的问题:
(1)大新发现运动后被汗水浸湿的衣服晾干,常出现白斑。其原因是________________。
(2)做馒头发酵面团时,会产生乳酸等有机酸,揉面团时需加入适量的纯碱或小苏打,让它们相互作用产生______________气体,使蒸出的馒头疏松多孔;若加入的纯碱或小苏打过多,可向面团或蒸锅中滴加少许酸性物质,如_______________,否则蒸出的馒头会变涩,颜色发黄。
(3)某企业因经营不善而停工,一年多来,许多机械设备上已锈迹斑斑。小强将设备上一枚生锈的铁螺丝放入足量的稀盐酸中,观察到铁锈逐渐消失,该反应的化学方程式为:__________。一段时间后,又观察到铁钉表面有气泡产生,写出产生气泡的化学方程式: ______。小强结合学过的化学知识,向留守的管理人员提出了一些防止机械设备进一步锈蚀的建议,请写出一条小强的建议:______________________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com