
4.元素周期率与元素周期表
(1)判断金属性或非金属性的强弱
金属性强弱
非金属性强弱
①最高价氧化物水化物碱性强弱
①最高价氧化物水化物酸性强弱
②与水或酸反应,置换出H2的易难
②与H2化合的易难或生成氢化物稳定性
③活泼金属能从盐溶液中置换出不活泼金属
③活泼非金属单质能置换出较不活泼非金属单质
(2)比较微粒半径的大小
①核电荷数相同的微粒,电子数越多,则半径越大:阳离子半径<原子半径<阴离子半径
如:H+<H<H?;Fe>Fe2+>Fe3+;Na+<Na;Cl<Cl?
②电子数相同的微粒,核电荷数越多则半径越小.即具有相同电子层结构的微粒,核电荷数越大,则半径越小。
如:① 与He电子层结构相同的微粒:H?>Li+>Be2+
② 与Ne电子层结构相同的微粒:O2?>F?>Na+>Mg2+>Al3+
③ 与Ar电子层结构相同的微粒: S2?>Cl?>K+>Ca2+
③电子数和核电荷数都不同的微粒
同主族:无论是金属还是非金属,无论是原子半径还是离子半径从上到下递增。
同周期:原子半径从左到右递减。
同周期元素的离子半径比较时要把阴阳离子分开。同周期非金属元素形成的阴离子半径大于金属元素形成的阳离子半径。
例如:Na+<Cl?;第三周期,原子半径最小的是Cl,离子半径最小的是Al3+
(3)元素周期结构
例如: ,△H1=△H2+△H3
,△H1=△H2+△H3
3.热化学方程式
(1)△H=生成物总能量-反应物总能量
=反应物中的总键能-生成物中的总键能
注意:①同一热化学方程式用不同计量系数表示时,△H值不同;②热化学方程式中计量系数表示物质的量;③能量与物质的凝聚状态有关,热化学方程式中需标明物质的状态;④△H中用“+”表示吸热;用“-”表示放热;⑤计算1 mol物质中所含化学键数目时,应首先区分晶体类型,分子晶体应看其分子结构(如P4中含6个P-P键,C60中含30个C=C键和60个C-C键),原子晶体应看其晶体结构,特别注意化学键的共用情况(如1 mol SiO2中含4 mol Si-O键,1 mol 晶体Si中含2 mol Si-Si键);⑥在表示可燃物燃烧热的热化学方程式中,可燃物前系数为1,并注意生成的水为液态。
(2)物质分子所含化学键的键能越大,则成键时放出的能量越多,物质本身的能量越低,分子越稳定。
(3)盖斯定律:一定条件下,某化学反应无论是一步完成还是分几步完成,反应的热效应相同。即反应热只与反应的始态和终态有关,而与反应所经历的途径无关(注意:进行相关计算时,热量应带“+”、“-”进行运算)。
2.离子共存问题
(1)弱碱阳离子只存在于酸性较强的溶液中:Fe3+、Al3+、Zn2+、Cu2+、NH4+、Ag+ 等均与OH?不能大量共存。
(2)弱酸阴离子只存在于碱性溶液中:CH3COO?、F?、CO32?、SO32?、S2?、PO43?、 AlO2?均与H+不能大量共存。
(3)弱酸的酸式阴离子在酸性较强或碱性较强的溶液中均不能大量共存。它们遇强酸(H+)会生成弱酸分子;遇强碱(OH?)会生成正盐和水:HSO3?、HCO3?、HS?、H2PO4?、HPO42?等。
(4)若阴、阳离子能相互结合生成难溶或微溶性的盐,则不能大量共存:Ba2+、Ca2+与CO32?、SO32?、PO43?、SO42?等;Ag+与Cl?、Br?、I? 等;Ca2+与F?,C2O42?等。
(5)若阴、阳离子发生双水解反应,则不能大量共存:Al3+与HCO3?、CO32?、HS?、S2?、AlO2?等;Fe3+与HCO3?、CO32?、AlO2?等。
(6)若阴、阳离子能发生氧化还原反应则不能大量共存:Fe3+与I?、S2?;MnO4?(H+)与I?、Br?、Cl?、S2?、SO32?、Fe2+等;NO3?(H+)与I?、S2?、SO32?、Fe2+等;ClO?与I?、S2?、SO32?等。
(7)因络合反应或其它反应而不能大量共存:Fe3+与SCN?;Al3+与F?等(AlF63?)。
(8)此外,还有与Al反应反应产生氢气的溶液(可能H+;可能OH?,含H+时一定不含NO3?);水电离出的c(H+)=10?13 mol/L(可能为酸溶液或碱溶液)等。
(5)某些物质中的化学键数目:如白磷(
(6)某些特殊反应中的电子转移数目:如Na2O2与H2O、CO2的反应(1 mol Na2O2转移1 mol电子;Cl2与H2O、NaOH的反应(1 mol Cl2转移1 mol电子。若1 mol Cl2作氧化剂,则转移2 mol电子);Cu与硫的反应(1 mol Cu反应转移1 mol电子或1 mol S反应转移2 mol电子)等。
(7)电解质溶液中因微粒的电离或水解造成微粒数目的变化:如强电解质HCl、HNO3等因完全电离,不存在电解质分子;弱电解质CH3COOH、HClO等因部分电离,而使溶液中CH3COOH、HClO浓度减小;Fe3+、Al3+、CO32?、CH3COO?等因发生水解使该种粒子数目减少;Fe3+、Al3+、CO32?等因发生水解反应而使溶液中阳离子或阴离子总数增多等。
(8)由于生成小分子的聚集体(胶体)使溶液中的微粒数减少:如1 mol Fe3+形成Fe(OH)3胶体时,微粒数目少于1 mol。
(9)此外,还应注意由物质的量浓度计算微粒时,是否告知了溶液的体积;计算的是溶质所含分子数,还是溶液中的所有分子(应考虑溶剂水)数;某些微粒的电子数计算时应区分是微粒所含的电子总数还是价电子数,并注意微粒的带电情况(加上所带负电荷总数或减去所带正电荷总数)。
(2)状态问题:标准状况时,H2O、N2O4、碳原子数大于4的烃为液态或固态;SO3、P2O5等为固态,不能使用
(3)特殊物质的摩尔质量及微粒数目:如D2O、18O2、H37Cl等。
(4)某些特定组合物质分子中的原子个数:如Ne、O3、P4等。
(1)条件问题:常温、常压下气体摩尔体积增大,不能使用
1.阿伏加德罗常数
求 的值及相应的
的值及相应的 的值。
的值。
2.过点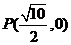 作倾斜角为
作倾斜角为 的直线与曲线
的直线与曲线 交于点
交于点 ,
,
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com