
A.
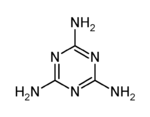 4.用NA表示阿伏加德罗常数的值,下列叙述正确的是
4.用NA表示阿伏加德罗常数的值,下列叙述正确的是
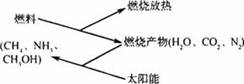
A.通过上述循环,太阳能最终转化为热能
B.所有可燃物燃烧时放出的能量均来源于太阳能
C.上述转化虽可循环,但之间的反应不属于可逆反应
D.上述转化不仅可以消除对大气的污染,还可以节约燃料,缓解能源危机
3.如下图所示,燃料在燃烧后的产物(如CO2、H2O、N2)等可以利用太阳能实现转化循环利用。则下列有关说法不正确的
2.以下说法中,符合科学规律的是( )
①改变核外电子数可使原子与离子相互转化 ②改变核内中子数可使同一元素不同核素相互转化 ③改变核内质子数可使同一元素的离子间相互转化 ④改变离子的电荷数可使一种元素的阳离子转化为另一种元素的阴离子
A.①③ B.②④ C.①② D.①②③④
1.
A.当碳纳米与物体表面接触时,它们之间会产生许多的范德华力
B.若将碳纳米晶体用作某些反应的催化剂时,其催化效率比普通碳高
C.碳纳米晶体管用作燃料电池负极时,可燃气体在负极上发生氧化反应
D.碳纳米晶体能与浓硫酸反应生成两种气体,但不能与浓硝酸反应
21.(10分)已知
(1)该反应的离子方程式为 。
(2)取阳极区溶液作系列实验,下列结论中错误的是 。(填字母)
A.滴加酚酞试剂,先变红后褪色 B.滴加硝酸银溶液,有白色沉淀产生
C.滴加小苏打溶液,有气泡产生 D.做焰色反应实验呈黄色
(3)计算原饱和NaCl溶液的质量(单位:kg)。
(4)若电解90%的NaCl所需电能是由甲烷燃料电池提供,则所需甲烷至少为多少m3?(折算成标准状况,假设该燃料电池的电量利用率为90%)
扬州市2008-2009学年度高三第一次调研测试
(2) 若实验Ⅰ中NO2的起始浓度改为1.2 mol?L-1,其它条件不变,则达到平衡时所需用的时间 40 min(填写“大于”、“等于”或“小于”) ,NO2的转化率将 (填写“增大”、“减小”或“不变”)。
(3)若实验Ⅰ中达平衡后,再向密闭容器中通入2 mol由物质的量之比为1:1组成的NO2与NO混合气体(保持温度不变),则平衡将 移动,新平衡状态时NO2的物质的量浓度为 mol?L-1。
(4)若将实验Ⅲ所得的平衡混和气体通入足量的水中,欲使气体被完全吸收则至少应同时通入标准状况下的空气 L。(设空气中N2与O2体积比4:1)
七、(本题包括1小题,共10分)
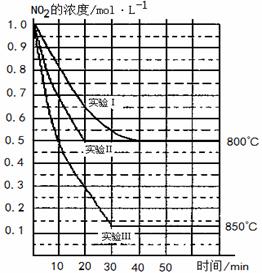 A. 实验Ⅱ和实验I相比,可能隐含的反应条件是:反应容
A. 实验Ⅱ和实验I相比,可能隐含的反应条件是:反应容
器的体积缩小了
B.实验Ⅱ和实验I相比,可能隐含的反应条件是:使用效
率更高的催化剂
C.实验I条件下该反应的平衡常数大于实验Ⅲ条件下该反
应的平衡常数
D.对比实验Ⅰ和Ⅲ可知,该反应是吸热反应
20.(10分)在 2NO(g)+O2(g)在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在
2NO(g)+O2(g)在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在
(1)对比实验Ⅰ、Ⅱ和Ⅲ,得出的下列结论中正确的是 。(填字母)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com