
19.(10分)
⑸A元素能与另外四种元素中的一种元素形成共价化合物,分子中的原子个数比为1:3,相对分子质量为120.5。则该物质的结构式为___________________。
六、(本题包括1小题,共10分)
18.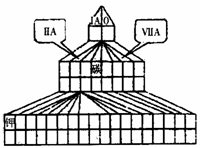 (10分)现有A、B、C、D四种短周期主族元素,其中原子序数依次增大。已知B和D同主族。A元素的最高正价和最低负价的绝对值之差为2;1molC单质能与冷水反应,在标准状况下生成11.2LH2;D-的电子层结构与Ar原子相同。请回答下列问题:
(10分)现有A、B、C、D四种短周期主族元素,其中原子序数依次增大。已知B和D同主族。A元素的最高正价和最低负价的绝对值之差为2;1molC单质能与冷水反应,在标准状况下生成11.2LH2;D-的电子层结构与Ar原子相同。请回答下列问题:
⑴在右图塔式周期表相应位置标出A、B、C、D 四 种元素的元素符号。同时在图中将过渡元素涂黑。
⑵B与C形成的化合物的电子式为____________。
⑶图中“钾”和D形成的简单离子的半径大小为________________(用离子符号和“>”、“=”或“<”表示)。
⑷元素非金属性强弱比较有很多方法,其中A和D的非金属性强弱的研究方案中比较可行的是_________(填序号)。
①比较两种单质的颜色 ②比较氢化物的稳定性
③比较原子半径大小 ④比较最高价氧化物对应水化物的酸性

请回答以下问题:
(1)沉淀池中发生的主要反应方程式是_______________________ ,该反应能够发生的原因______________________________________。
(2)提纯滤液以获得(NH4)2SO4晶体,必要的操作步骤是____________(填写序号)。
A.蒸干 B.蒸发 C.冷却结晶 D.过滤
(3)该生产过程中可以循环使用的X是_________________________。
⑷上述生成流程中,有关NH3的作用及说明正确的是____________(填写序号)。
A.提供制备所需的氮元素 B.增大CO32-的浓度促进反应发生
C.作反应的催化剂 D.生产1mol(NH4)2SO4,至少消耗2mol NH3
五、(本题包括1小题,共10分)
元素周期表除了我们常见的长式周期表外,还有多种表现形式。右下图是元素周期表的另一种画法――塔式周期表,在上面标有部分族及部分元素。
17.(10分)某化工厂为了综合利用生产过程中的副产品CaSO4,与相邻的合成氨厂联合设计了以下制备(NH4)2SO4的工艺流程:
8.00?
14
(1)表中x = 。
(2)某同学在没使用温度计的情况下,通过右图所示装置完成了实验。则该同学根据
判断NaOH溶液与稀盐酸发生了中和反应。
|