
C.X是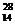 Si的同位素 D.X是
Si的同位素 D.X是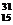 P的同位素
P的同位素
【答案】BD
【解析】根据核反应方程质量数和电荷数守恒可知选项B、D正确。
A.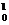 n是质子 B.
n是质子 B.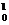 n是中子
n是中子
2.铝箔被α粒子轰击后发生了以下核反应: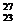 Al+
Al+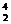 He→X+
He→X+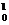 n.下列判断正确的是
n.下列判断正确的是
1.伽利略在著名的斜面实验中,让小球分别沿倾角不同、阻力很小的斜面从静止开始滚下,他通过实验观察和逻辑推理,得到的正确结论有
A.倾角一定时,小球在斜面上的位移与时间成正比
B.倾角一定时,小球在斜面上的速度与时间成正比
C.斜面长度一定时,小球从顶端滚到底端时的速度与倾角无关
D.斜面长度一定时,小球从顶端滚到底端所需的时间与倾角无关
【答案】B
【解析】倾角一定时,小球在斜面上的位移与时间的平方成正比,在斜面上的速度与时间成正比,故选项A错误,选项B正确。斜面长度一定时,小球从顶端滚到底端时的速度与倾角有关,从顶端滚到底端所需时间与倾角有关,故选项C、D错误。
在制造钛白过程中,需要测定钛白Ti(Ⅳ)的含量。测定时首先取10mL钛液用水冲稀10倍,加过量铝粉,充分振荡,使其完全反应,Ti(Ⅳ)+Al→Ti3++Al3+。过滤后,取出滤液20mL,向其中滴加2~3滴KSCN溶液,再加5 mL蒸馏水振荡,用酸式滴定管滴加0.1mol/L FeCl3溶液,终点到来时,用去了30mL的FeCl3溶液。求原钛液的物质的量浓度。
2008―2009学年度第一学期高三年级期中调研测试
过程为:在冰水浴强力搅拌下,将一定量的TiCl4滴加到溶有HCl和(NH4)2SO4的冰的TiCl4水溶液中,控制TiCl4浓度为1.1mol/L时撤去冰浴,逐步升温到
⑶简述升温和调节溶液pH的目的: 。
⑷试用简要的文字和相应的离子方程式判断说明产物中无Cl-和SO42-:
。
Ⅲ.普通钛白的化学制法通常是硫酸法。首先使磨细的钛铁矿用浓硫酸在不断地通入空气搅拌的条件下进行反应,制得可溶性二水合硫酸氧盐,其反应方程式:FeTiO3+2H2SO4=FeSO4+TiOSO4?2H2O;趁热过滤,所得滤液叫钛液,加热钛液,促进水解,制得一水合二氧化钛沉淀(TiO2?H2O);然后在1173K~1223K煅烧即得普通钛白。
TiCl4+4NH3+(n+2)H2O TiO2?nH2O+4NH4Cl。
TiO2?nH2O+4NH4Cl。
⑴已知:①C(s)+O2(g)=CO2(g) △H=-393.5kJ?mol-1
②2CO(g)+O2(g)=2CO2(g) △H=-566kJ?mol-1
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) △H=+141kJ?mol-1
则TiO2(g)+2Cl2(g)+
(2)如何从上述所得产物中获得纯净金属钛?简述主要步骤:
。
Ⅱ.纳米TiO2可通过TiCl4水解制备:
21.(12分)Ⅰ.钛白在自然界中以金红石矿存在。目前大规模生产钛的方法是:
第一步 首先将金红石、炭粉混合,在高温条件下通入氯气制得TiCl4;
第二步 在氮气氛围中用过量的镁在加热条件下与TiCl4反应制得金属钛。
是日常生活中接触最多的过渡金属元素,密度为7.8g/cm3
试回答下列问题:
⑴元素A的原子核外未成对电子有 个。元素B在周期表中的位置是
。
(2) 基态E原子的核外电子排布为 。
⑶由A、C、D三种元素组成的化合物在水中存在的电离方程式为:
。
⑷只包含A 、D、E三种元素的一种化合反应的化学方程式为:
。
八、(本题包括1小题,共12分)
“未来金属”钛(Ti)因具有强抗腐蚀性,一般不与稀酸反应,而广泛应用于军工、化工等领域。钛白(TiO2)是目前最好的白色颜料,且纳米TiO2光催化技术已成为解决环境问题的有效途径。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com