

请回答以下问题:
(1)若C是可用作自来水消毒的气体,D、E是氧化物,D转化为E时,增加氧的质量
20.(8分)如图,各物质有下列转化关系:
①写出由纯SiHCl3制备高纯硅的化学反应方程式___________________________;www. Ks5 u.c om
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl
和另一种物质,写出配平的化学反应方程式_____________________,H2还原
SiHCl3过程中若混O2,可能引起的后果是____________________________;
(2)下列有关硅材料的说法正确的是________________(填字母):
A.碳化硅化学性质稳定,可用于生产耐高温水泥
B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
C.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
D.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
E.高纯度的二氧化硅可用于制造高性能通讯材料――光导纤维
(3)硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中,逐滴加入饱和氯化铵溶液,振荡。写出实验现象_________________________________________。
19.(10分)硅单质及其化合物应用范围很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
(6)Z的最高价氧化物为无色液体,0.25 mol该物质与一定量水混合得到一种稀溶液,
并放出QkJ的热量。写出该反应的热化学方程式:_______________________。
18.(10分)W、X、Y、Z是原子序数依次增大的同―短周期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物可以反应生盐和水,该反应的离子方程式
为__________________________________________________;
(2)W与Y可形成化合物W2Y,该化合物的电子式为__________________________;
(3)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为_____________:
(4)比较Y、Z气态氢化物的稳定性:____________>___________(用分子式表示);
(5)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是:
______________>_____________>______________>_____________;
17.(9分)请回答下列化工知知识.
(1)脱除天然气中的硫化氢既能减少环境污染,又可回收硫资源。硫化氢与FeCl3溶液 反应生成单质硫,其离子方程式为 ________________________________;如果用过量NaOH溶液吸收硫化氢后,以石墨作电极电解该溶液可回收硫,其电解总 反应方程式(忽略氧的氧化还原)为 __________________________________,该方法的优点是______________________________________________________;
(2)电解饱和食盐水常用离子膜电解槽和隔膜电解槽。阳离子膜和隔膜均允许通过的
分子或离子是______________,电解槽中的阳极材料为 ____________________;
(3)第ⅢA、VA元素组成的化合物GaN、GaP、CaAs等是人工合成的新型半导体材料,
其晶体结构与单晶硅相似。在GaN晶体中,每个Ga原子与____________个N原
子相连,与同一个Ga原子相连的N原子构成的空间构型为_____________。

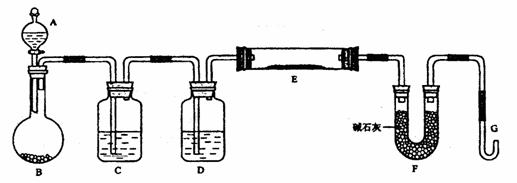
请回答下列问题:
(1)仪器中装入的试剂:C__________、D__________;
(2)连接好装置后应首先___________,其方法是__________:
(3)“加热反应管E”和“从A瓶逐滴滴加液体”这两步操作应该先进行的是_________,
在这两步之间还应进行的操作 ________________________;
(4)从实验中测得了下列数据
①空E管的质量a ②E管和WO3的总质量b
③反应后E管和W粉的总质量c (冷却到室温称量)
④反应前F管及内盛物的总质量d ⑤反应后F管及内盛物的总质量e
由以上数据可以列出计算W的相对原子质量的两个不同计算式(除W外,其他涉
及的元素的相对原子质量均为已知):
计算式1:Ar(W)=____________:计算式2:Ar(W)=___________。
16.(10分)某课外小组利用H2还原黄色的WO3粉末测定W的相对原子质量,下图是测定装置的示意图,A中的试剂是盐酸。
15.下列说法中正确的是( )
A.离子晶体中每个离子周围均吸引着6个带相反电荷的离子
B.金属导电的原因是在外电场作用下金属产生自由电子,电子定向移动
C.分子晶体的熔沸点很低,常温下都呈液态或气态
D.原子晶体中的各相邻原子都以共价键相结合
第Ⅱ卷(非选择题,共55分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com