
19、(10分)A、B、C、D、E都是短周期主族元素,原子序数依次增大,B、C同周期,A、D同主族,E的单质既可溶于稀硫酸又可溶于氢氧化钠溶液。A、B能形成两种在常温下呈液态的化合物甲和乙,原子个数比分别为2:1和l:1。根据以上信息回答下列问题:
(1)甲、乙两分子中含有非极性共价键的物质的电子式是 ,
(2)C和D的离子中,半径较小的是 (填离子符号)。
(3)实验室在测定C的气态氢化物的相对分子质量时,发现实际测定值比理论值大出许多,其原因是 。
18、(12分) (1) 水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。水分子在特定条件下容易得到一个H+,形成水合氢离子
(H3O+)。下列对上述过程的描述不合理的是 (填写序号)
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
(2) 随着人类对水的研究的不断深入,水的应用也越来越广泛。研究人员最近发现,在一定的实验条件下,给水施加一个弱电场,在
A.代替干冰 B.防止冰川熔化
C.在室温下制作冰雕 D.建室温溜冰场
(3)写出与H2O分子互为等电子体的微粒 ;将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子。请写出生成此配合离子的离子方程式: 。
(4)火星探测车在火星大气中检测到了气体A。资料显示,A分子是三原子分子,其相对分子质量为60,在地球环境下A易分解。粉未状的KSCN与浓硫酸在一定条件下可得到气体A和二种硫酸氢盐,,生成物的物质的量之比是1∶1∶1。则气体A的结构式是 。
(5)新型离子化合物[HC60]+[CB11H60Cl60]-是一种功能材料。它可以用超酸H(CB11H60Cl60)和C60反应,使C60得到质子来制取。该反应类型跟中学课本中的一个化学反应类似,课本中的这个反应是(写一个化学方程式) 。
五、本题共2题(20分)
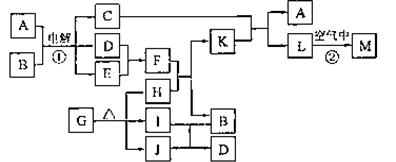
(1)写出:A的电子式 ,J的结构式 ,M的化学式 。
(2)基于反应①原理的化学工业称为 ,写出该反应的化学方程式 。
(3)写出K和E反应的离子方程式 。
写出F溶液和H反应的离子方程式 。
(4)已知由G分解得到的H、I、J三者的物质的量相等,则G的化学式为 。
17、(12分)下图表示各物质之间的转化关系。
已知:常温下D、E、F、I、J为气体;C的焰色反应为黄色;M为有颜色的固体。
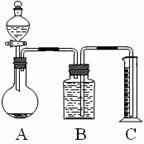 (2)乙组:气体分析法把一定量的混合物与足量盐酸反应后,用如图装置测定产生的CO2气体的体积,为减小CO2的溶解,B中溶液应是_________________,选用该溶液后实验结果还是不准确,原因是______________________________。
(2)乙组:气体分析法把一定量的混合物与足量盐酸反应后,用如图装置测定产生的CO2气体的体积,为减小CO2的溶解,B中溶液应是_________________,选用该溶液后实验结果还是不准确,原因是______________________________。
(3)请你设计一个与甲、乙两组操作不同的实验方案,测定混合物
中Na2CO3的含量。
方法:__________________________________。
用到的主要试剂:_____________________________(至少2种)。
用到的玻璃仪器:___________________________(至少2件)。
16、(12分) 甲、乙两个实验小组分别进行“测定Na2CO3和NaCl混合物中Na2CO3含量”的实验。
(1)甲组:沉淀分析法
把一定量的混合物溶解后加入过量CaCl2,然后将所得沉淀过滤、洗涤、烘干、称量。确定CaCl2溶液是否过量的方法是______________________________________________,洗涤沉淀并判断沉淀是否洗净的操作是___________________________________________________。
15、(6分)
(1)二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3在H2SO4存在下与SO2反应制得。请写出反应的离子方程式:
。
(2)漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年,亚氯酸不稳定可分解,反应的离子方程式为:HClO2 → ClO2↑+ H+ +Cl-+H2O(未配平)。当1 mol HClO2发生分解反应时,转移的电子数是 。(设阿伏加德罗常数为NA)
(3)过碳酸钠是一种有多用途的新型氧系固态漂白剂,化学式可表示为Na2CO3?3H2O2,它具有Na2CO3和H2O2的双重性质。过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只发生了氧化反应的是 。
A.MnO2 B.KMnO4溶液 C.稀盐酸 D.Na2SO3溶液
A.0.24mol B.0.21mol C.0.16mol D.0.14mol
第II卷(非选择题)
14.向一定量的Fe、FeO和Fe2O3的混合物中加入120mL
4mol/L的稀硝酸,恰好使混合物完全溶解,放出
13、某无色溶液中可能含有Na+、K+、Fe3+、NH4+、Cu2+、SO42-、SO32-、CO32-、Cl-、Br- 这几种离子中的若干种,依次进行下列实验,观察到的现象记录如下:①pH试纸检验,溶液的pH>7。②取少量原溶液,向溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成。③另取少量原溶液,向溶液中滴加足量氯水,无气体产生,再加入CCl4振荡,静置后CCl4层呈橙色,用分液漏斗分液。④向分液后的水溶液中加入Ba(NO3)2和HNO3溶液,有白色沉淀产生,过滤。⑤在滤液中加入AgNO3和HNO3的混合溶液有白色沉淀产生。则关于原溶液的判断中不正确的是
A.肯定不存在的离子是Fe3+、Cu2+、NH4+、SO42-、CO32-
B.肯定存在的离子是Na+、K+、SO32-、Br- 、Cl-
C.无法确定原溶液中是否存在Cl-
D.若步骤④改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断无影响。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com