
B、CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-192.8kJ/mol
A、CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0kJ/mol
(3)反应中若产生0.2mol气体,则转移电子的物质的量是 ▲ mol。
(II)随着科学技术的进步,人们研制出了多种类型的甲醇质子交换膜燃料电池,以满足不同的需求。有一类甲醇质子交换膜燃料电池,需将甲醇蒸气转化为氢气,两种反应原理是:
16.(10分)(I)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:
NO3-+4H++3e-→NO+2H2O.
KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式: ▲ 。
(2)反应中硝酸体现了 ▲ 、 ▲ 性质。

请回答下列问题:
(1)下列关于PAFC的说法中正确的是 ▲
A.PAFC是一种无机高分子化合物
B.PAFC中Fe显+2价
C.PAFC溶于水能电离出OH-,是一种碱
D.PAFC在强酸性和强碱性溶液中均不能稳定存在
(2)步骤I中加入过量稀盐酸的目的一方面是使固体完全溶解,另一方面是 ▲ 。
(3)步骤II中取样分析的目的是测定溶液中Fe2+的含量,以确定加入NaClO3,写出向溶液中加入NaClO3时,发生反应的离子方程式为 ▲ 。
(4)该化工厂的化验室为测定产品PAFC中Al和Fe两种元素的含量,进行下列试剂的选择和基本操作:测定时所需的试剂有 ▲ 。
A.NH3?H2O B.NaOH C.CO2 D.NaClO3
在测定过程中的操作顺序是:过滤、 ▲ 、灼烧、冷却、 ▲ 。
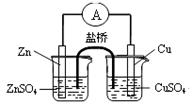 B.构成右图所示装置时,盐桥中的K+ 向左池移动
B.构成右图所示装置时,盐桥中的K+ 向左池移动
C.不宜用瓷坩埚灼烧氢氧化钠或碳酸钠
D.配制10%的ZnSO4溶液时,可将l
溶解在
E.向某溶液中滴加氯化钡溶液,产生不溶于稀硝酸的
白色沉淀,则该溶液中一定含有SO42-
F.配制一定物质的量浓度的溶液,定容时俯视容量瓶的刻度线,会使所配溶液浓度偏高。
(II)一种新型高效净水剂PAFC――聚合氯化铁铝[A1Fe(OH)nCl6-n]m,广泛用于日常生活用水和工业污水的处理。某化工厂欲以工业生产废料(金属铁、铝及其氧化物)为原料制取PAFC,设计生产流程如下图。
15.(14分)(I)下列有关实验的叙述中,合理的是 ▲ (填序号)
A.把SO2通入紫色石蕊试液,可验证SO2的漂白性
A.①中所得溶液中c(Cl―)-c(M+)=9.9×10―7mol/L
B.①c(H+)-c(MOH)= 1×10―8mol/L
C.由②中信息知MOH的电离程度<M+的水解程度
D.②中所得溶液中各离子浓度大小关系为:c(M+)>c(Cl―)> c(H+)>c(OH-)
第II卷(非选择题 共72分)
②室温下如果取0.2mol/LMOH溶液与0.1mol/L盐酸等体积混合,测得混合溶液的pH<7。
下列说法中不正确的有( )
14.①温室下取0.2mol/L的盐酸与0.2mol/LMOH等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com