
24.(8分)将51 g镁铝合金溶于60 mL 50mol·L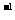 H
H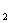 SO
SO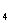 溶液中,完全溶解后再加入65 mL10.0 mol·L
溶液中,完全溶解后再加入65 mL10.0 mol·L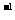 的NaOH溶液,得到沉淀的质量为9.7 g,继续滴加NaOH溶液时沉淀会减少。
的NaOH溶液,得到沉淀的质量为9.7 g,继续滴加NaOH溶液时沉淀会减少。
(1)当加入________mLNaOH溶液时,可使溶液在硫酸中的Mg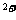 和Al
和Al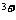 恰好完全沉淀。
恰好完全沉淀。
(2)计算合金溶于硫酸时所产生的氢气在标准状况下的休积。
23.(10分)一种用于治疗高血脂的新药灭酯灵是按下图所示路线合成的。
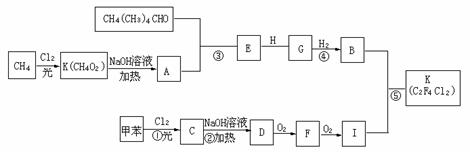
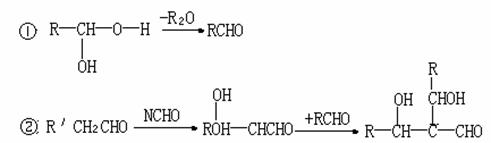
已知:H的分子式为C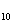 H
H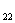 O
O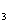 试回答:
试回答:
(1)写出G的结构简式:____________________________。
(2)在反应②③④⑤中属于取代反应的是____________(填序号)。
(3)写出下列反应的化学方程式:
反应②__________________________________________
反应⑤__________________________________________
F与银氨溶液反应___________________________________
22.(4分)某有机物含有C、H、O、N四种元素,下图为该有机物的球棍模型。
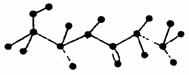 (1)该有机物的结构简式为________________。
(1)该有机物的结构简式为________________。
(2)该有机物不可能发生的化学反应有________(填序号)。
①水解 ②加聚 ③取代 ④消去 ⑤酯化 ⑥缩聚
21.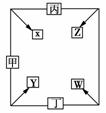 (8分)甲、乙、丙、丁四种单质在点燃条件下反应生成X、Y、Z、W四种化合物,其转化关系如右图所示。又如:
(8分)甲、乙、丙、丁四种单质在点燃条件下反应生成X、Y、Z、W四种化合物,其转化关系如右图所示。又如:
①甲、乙、丙均为前三周期元素的单质,常温下均为气态;
丁是日常生活中一种常见的金属。
②常温下X是无色液体,Y是黑色固体。
③丙在乙中燃烧发出苍白色火焰,丁在乙中燃烧生成棕黄色的烟,W的水溶液呈黄色。
(1)丁在甲和X同时存在的条件下,可发生电化腐蚀,写出正极上的电极反应式:
_ _______________。
(2)将少量W的饱和溶液滴入热的X中,反应的化学方程式是____________________。
(3)若Z、W两溶液的pH均等于5,则两溶液中由水电离出的H 的物质的量浓度之比
的物质的量浓度之比
为________________。
(4)已知5.6 L(标准状况)气体丙在甲中完全燃烧放出热量为71.45 KJ,则能正确表示丙燃烧的热化学方程式为___________________________。
20.(7分)已知X、Y、Z、W均为短周期元素,其原子序数依次增大。X和Y可形成常见化合物YX,一个YX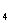 分子中共有10个电子;Z单质在通常状况下为无色无味气体;W原子的最外层电子数是核外电子总数的3/4。试回答:
分子中共有10个电子;Z单质在通常状况下为无色无味气体;W原子的最外层电子数是核外电子总数的3/4。试回答:
(1)由X、Z、W三种元素可组成一种盐,该盐是常用的速效化肥,不宜与碱性肥料混合或在碱性土壤中施用,其原因是_______________________________________。
(2)由X、Y、Z、W四种元素可组成多种化合物,其中既能与盐酸又能与烧碱溶液反应的无机物是______________,有机物是___________________(各写一种)。
(3)将1.2 gY单质在足量W单质中燃烧所得的气体通入150 mL
1mol·L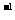 NaOH溶液中,完全反应后溶液中离子浓度由大到小的顺序是____________________。
NaOH溶液中,完全反应后溶液中离子浓度由大到小的顺序是____________________。
19.(12分)下图所示装置中,a是盛有标况下224 mL空气(氧气占五分之一)和10 mL 1.2 mol/L硝酸的烧瓶,b是未充气(实验开始前内部没有气体)装有0.384 g铜粉的气球,c是夹紧了的弹簧夹,d中盛有足量的过氧化钠,e是充有二氧化碳的注射器。整套装置经过气密性检查已合格。
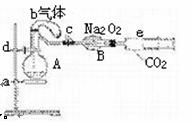
(1)将气球中的铜粉小心倒入烧瓶中,充分反应后发现铜粉有
剩余(设产生的气体不溶解于溶液中),则可观察到的现象是___________________。
(2)欲提高铜与硝酸反应的速率可采用多种不同的措施,若用加入化学试剂法,下列试
剂中可以使用的是(填代号)________________________。
A.蒸馏水 B.无水醋酸钠 C.石墨 D.硝酸银(少量)
(3)将烧瓶充分振荡,所观察到的现象是____________________________;有关反应的化学方程式__________________________________________________。
(4)打开弹簧夹e,将二氧化碳推入干燥管内,使反应充分进行。将烧瓶中反应的全过程用一个总的化学方程式表示:_______________________________________。
(5)欲使所有的铜粉都溶解,至少需要推入二氧化碳_________mL(设推入的二氧化碳全部反应)。
18.(5分)为确认C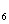 H
H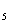 OH、H
OH、H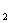 CO
CO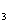 和CH
和CH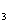 COOH
COOH
的酸性强弱,某学生设计了如图所示的装置,一次
实验即可达到目的(不必选其他酸性物质)。请据此实验回答:
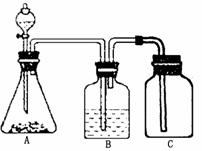
(1)锥形瓶中装某可溶性正盐溶液,分液漏斗中所盛试剂应为_______________。
(2)装置B所盛的试剂是___________________,其作用是____________________。
(3)装置C所盛的试剂是_______________,C中反应的离子方程式_____________。
17.下列各选项所述的两个量,前者一定大于后者的是 ( )
①F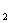 和Br
和Br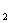 的沸点 ②纯水在25℃和80℃时的pH
的沸点 ②纯水在25℃和80℃时的pH
③同温下分别在100 g水中最多能溶解的无水CuSO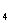 和CuSO
和CuSO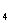 · 5H
· 5H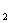 O的质量
O的质量
④25℃时,等体积的pH都等于3的盐酸和AlCl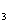 溶液中,已电离的水分子数
溶液中,已电离的水分子数
⑤在NH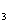 +NO-→ N
+NO-→ N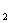 +H
+H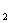 O反应中,被氧化和被还原的N原子数
O反应中,被氧化和被还原的N原子数
⑥耐火材料MgO和CaO的熔点 ⑦H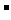 和H
和H 的离子半径
的离子半径
A.①②④ B.②③⑤ C.②⑥⑦ D.⑤⑥⑦
第二卷(非选择题,共54分)
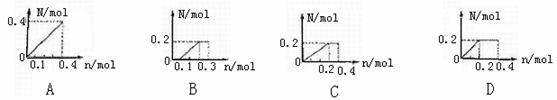
16.将0.4 mol铁粉逐渐加入到含硝酸0.8 mol的稀硝酸中,反应生成气体的物质的量N随消耗铁粉的物质的量n变化关系正确的是 ( )
15.一定条件下,对于可逆反应X(g)+3Y(g) 2Z(g),若X、Y、Z的起始浓度分别为c
2Z(g),若X、Y、Z的起始浓度分别为c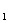 、c
、c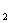 、c
、c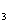 (均不为零),到达平衡时,X、Y、Z的浓度分别为0.1 mol·L
(均不为零),到达平衡时,X、Y、Z的浓度分别为0.1 mol·L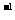 、0.3 mol·L
、0.3 mol·L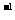 、0.08 mol·L
、0.08 mol·L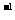 ,则下列判断不合理的是 ( )
,则下列判断不合理的是 ( )
A.c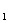 :c
:c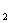 =1:3 B.平衡时,Y和Z的生成速率之比为2:3
=1:3 B.平衡时,Y和Z的生成速率之比为2:3
C.X、Y的转化率相等 D.c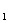 的取值范围为0<c
的取值范围为0<c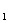 <0.14 mol·L
<0.14 mol·L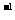
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com