
5.在盛有饱和Na2CO3溶液的烧杯中,插入惰性电极,保持温度不变,通电一定的时间后,下列判断正确的是
A.溶液的pH将增大 B.Na+数和CO32-数的比值将变小 C.溶液浓度不变,有晶体析出 D.溶液浓度逐渐增大并有晶体析出
4.常温下,下列各组物质不能用一种试剂通过化学反应区别的是
A.MnO2 CuO FeO B.Na2CO3 NaHCO3 K2CO3
C.AgNO3 KNO3 Na2CO3 D.(NH4)2SO4 K2SO4 NH4Cl
3. 用惰性材料作电极,分别电解下列物质,当通过相同电量时,下列指定的电极上析出气体质量最大的是
A.NaOH溶液(阴极) B.NaCl溶液(阴极)
C.熔融的NaCl(阳极) D.Na2SO4溶液(阳极)
2.接触法生产H2SO4过程,对废气、废水、废渣、“废热”的处理正确的是
①尾气用氨水处理;
②污水用石灰乳处理;
③废渣用来造水泥,炼铁;
④设置“废热”锅炉产生蒸气,供热或发电
A.只有①② B.只有①③④ C.只有①②③ D.全部
1.下列说法正确的是
A.NaCl溶液、MgCl2溶液、KNO3溶液、Al2(SO4)3溶液可以用一种试剂加以区别
B.合成氨工业与接触法制硫酸中SO2催化氧化的过程中都采用了高压的生产条件
C.在医院中为酸中毒病人输液不应采用0.9%氯化铵溶液
D.汽车排放的尾气中含有氮氧化物的主要原因是汽油燃烧不充分引起的
26.(10分)在标准状况下将cmolCl2通入含amolFeBr2、bmolFeI2的溶液中,当c取不同值时,反应后所得溶液中有不同溶质(不考虑生成物与水的反应)。
(1) 将下表中空格填满:
|
c的取值(用含a、b的代数式表示) |
反应后溶液中溶质的化学式 (只要求写盐类化合物) |
|
|
FeBr2、FeI2、FeCl2 |
|
b≤c<1/2(a+3b) |
|
|
|
FeBr3、FeCl3 |
|
|
FeCl3 |
(2)若a=b=1 、c=2时,反应后溶液中属于盐类的溶质是 (写化学式),这些溶质的物质的量之比是 ;
(3)若a=b=1 、c=2.5时,写出Cl2通入溶液中总的离子方程式(限写一个,但需包括所有的离子反应): 。
25.(6分)A、B两只质量不等的烧杯各放入质量不等但均含有9.8g溶质的硫酸溶液,分置于托盘天平的左右两盘,天平不平衡。再分别在A、B两烧杯中加入质量相等的铁粉和锌粉,反应停止后,发现天平平衡,则
⑴反应前A、B两烧杯(含内置硫酸溶液)的最大质量差是____________________。
⑵此情况下,铁粉和锌粉质量的取值范围是___________________________________。
24.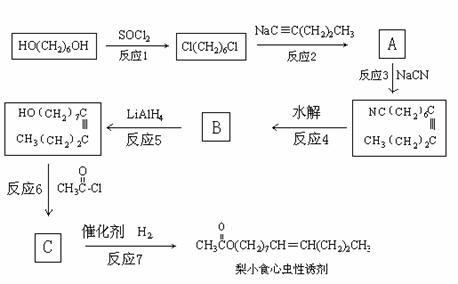 (10分) 性外激素是一种昆虫性诱剂,它由雌性昆虫尾腹部放出,藉以引诱异性昆虫。昆虫对性外激素的识别能力很强。很多性外激素是长链脂肪醇的酯。梨小食心虫的性诱剂可由下列合成路线合成:
(10分) 性外激素是一种昆虫性诱剂,它由雌性昆虫尾腹部放出,藉以引诱异性昆虫。昆虫对性外激素的识别能力很强。很多性外激素是长链脂肪醇的酯。梨小食心虫的性诱剂可由下列合成路线合成:
请回答下列问题:
(1) A的结构简式为:________________________ ,名称是_______________________
(2) 反应1的类型为______________________,反应5的类型为__________________
(3) 反应3的作用是______________________,B的结构简式为____________________
(4) 写出反应6的化学方程式:_______________________________________________
(5) 梨小食心虫性诱剂的最简单的同系物的结构简式为:__________________________
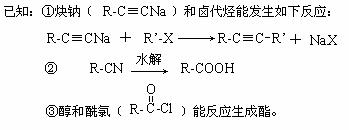
23.(10分)键线式是有机物结构的又一表示方法,如图I所表示物质的键线式可表示为图II所示形式。松节油的分馏产物之一A的结构可表示为图III。
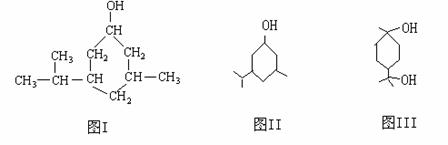
(1) 写出A的分子式___________________
(2) A在浓H2SO4的作用下加热,每一分子A可失去一分子水得不饱和化合物B。写出B可能的结构简式___________________________________________________________________
(3) C是B的同分异构体。其分子里也有一个六元碳环,其碳环上的碳原子均是饱和的。如果C分子中六元环上只有一个取代基,则C具有多种结构,请写出其中的两种结构(必须是不同类别的物质,用键线式表示)
___________________________、____________________________________.
22.(12分)下列A到I是由短周期元素组成的常见物质,其中氧化物D、氧化物F是不成盐氧化物,单质E可作半导体材料。
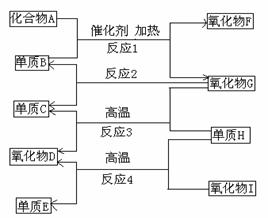
回答下列问题:
(1)化合物A的电子式是 ,氧化物F的化学式是 ;
(2)反应1在工业上的用途是 ,写出氧化物F与单质B反应的产物和氧化物G反应的化学方程式 ;
(3)组成单质E的元素在元素周期表中的位置是 ,单质H和单质E均可形成和氧化物I相同的晶体,其中熔点高的是 ,原因是
;
(4)单质B和单质C在一定条件下可组成原电池[用KOH(aq)作电解质]则该原电池的负极反应方程式是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com