
35.石油及其分馏产物在供氧不足时燃烧,常常产生CO,这也是常见的大气污染物之一。将某气态烃在5倍体积的纯氧中燃烧,产物通过足量Na2O2并在电火花连续作用下充分反应,生成的气体体积缩小到燃烧后产物体积的3/8(气体体积都在100℃以上,1.01×105Pa时测定)
(1)试写出通式为CXHY的某烃在供氧不足时燃烧的化学方程式 (CO2的系数设定为m)
(2)当m=2时,求该烃的分子式。
(3)若1摩某气态烃在供氧不足时燃烧,产物在足量Na2O2的电火花连续作用下产生3摩氧气,且固体Na2O2增重范围为90克≤△W≤118克,求烃可能的分子式和燃烧产物CO与CO2的物质的量之比,将结果填入下表
|
烃的分子式 |
nco/nCO2 |
|
|
|
34.近年来。工业上用Mg(NO3)2替代浓H2SO4作为制取浓HNO3的脱水剂(以下数据均为质量百分比浓度)。65%HNO3(质量为M1)中加72%Mg(NO3)2溶液(质量为M2)后蒸馏。分别得到97.5%HNO3和60%Mg(NO3)2溶液(不含HNO3)。(1)若蒸馏过程中HNO3.Mg(NO3)2.H2O均无损耗,求蒸馏前的投料比M1/M2的值。(2)蒸馏过程中,若H2O的损耗占总质量的5.0%,即有M1+M2×5.0%的H2O流失。则投料时,比值M1/M2应该 (选填增大.减小或不变)。
33.化合物C和E都是医用功能高分子材料,且有相同的元素百分组成,均可由化合物A(C4H8O3)制得,如下图所示,B和D互为同分异构体。
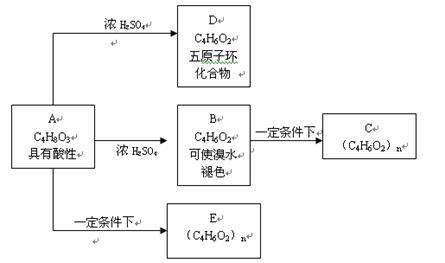
试写出:化学方程式A→D. ,
B→C ,
反应类型A→B. ,B→C. A→E ,
A的结构简式的同分异构体(同类别且有支链)的结构简式: 及
32.化学式为C8H10O的化合物A 具有如下性质:
①A+Na→慢慢产生气泡 ②A+RCOOH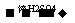 有香味的产物 ③A
有香味的产物 ③A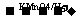 苯甲酸 ④催化脱氢产物不能发生银镜反应
⑤脱水反应的产物,经聚合反应可制得一种塑料制品(它是目前造成主要的“白色污染”源之一)。
苯甲酸 ④催化脱氢产物不能发生银镜反应
⑤脱水反应的产物,经聚合反应可制得一种塑料制品(它是目前造成主要的“白色污染”源之一)。
试回答:
(1)根据上述信息,对该化合物的结构可作出的判断是 (多选扣分) a苯环上直接连有羟基 b肯定有醇羟基 c苯环侧链未端有皿基 d肯定是芳香烃
(2)化合物A的结构简式 ,
(3)A和金属钠反应的化学方程式
31.氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
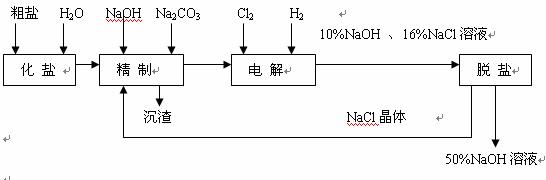
依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上所发生反应的化学方程式为 ,与电源负极相连的电极附近,溶液pH值 (选填:不变.升高或下降)
(2)工业食盐含Ca2+.Mg2+等杂质。精制过程发生反应的离子方程式为 ,
(3)如果粗盐中SO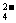 含量较高,必须添加钡式剂除去SO
含量较高,必须添加钡式剂除去SO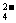 ,该钡试剂可以是
(选填a.b.c,多选扣分) A.Ba(OH)2 B.Ba(NO3)2 C.BaCl2
,该钡试剂可以是
(选填a.b.c,多选扣分) A.Ba(OH)2 B.Ba(NO3)2 C.BaCl2
(4)为有效除去Ca2+.Mg2+.SO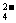 ,加入试剂的合理顺序为
(选填a,b,c多选扣 分)
,加入试剂的合理顺序为
(选填a,b,c多选扣 分)
A.先加NaOH,后加Na2CO3,再加钡试剂
B.先加NaOH,后加钡试剂,再加Na2CO3
C.先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaoH和NaCl在溶解度上的差异,通过 .冷却. (填写操作名称)除去NaCl
(6)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为
30.用下列仪器.药品验证由铜和适量浓硝酸反应产生的气体中含NO(仪器可选择使用,N2和O2的用量可自由控制)。
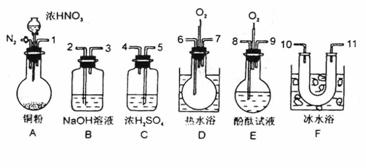
已知:①NO+NO2+2OH-→2NO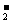 +H2O②气体液化温度:NO2 21℃ NO -152℃
+H2O②气体液化温度:NO2 21℃ NO -152℃
试回答:
(1)仪器的连接顺序(按左→右连接,填各接口的编号)为
(2)反应前先通入N2目的是
(3)确认气体中含NO的现象是
(4)装置F的作用是
(5)如果O2过量,则装置B中发生反应的化学方程式为:
29.高炉炼铁中发生的基本反应之一如下:FeO(固)+CO(气)≒Fe(固)+CO2(气)-Q ,其平衡常数可表达为 K=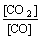 ,已知1100℃时,K=0.263 。
,已知1100℃时,K=0.263 。
(1)温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO和体积比值
平衡常数K值 (本小题空格均备选:增大.减小或不变)
(2)1100℃时测得高炉中[CO2]=0.025mol/L [CO]=0.1mol/L,在这种情况下,该反应是否处于化学平衡状态 (选填是或否),此时,化学反应速度是V正 V逆(选填大于.小于或等于),其原因是
28.汽车尾气(含有烃类.CO.SO2与NO等物质)是城市空气的污染源。治理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂.钯合金作催化剂)。它的特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧及SO2的转化。
(1)写出一氧化碳与一氧化氮反应的化学方程式
(2)“催化转换器”的缺点是在一定程度上提高空气的酸度,其原因是
(3)控制城市空气污染源的方法可以有 (多选扣分)
A.开发氢能源 B.使用电动车 C.植树造林 D.戴上呼吸面具
27.a.b.c.d.e.f.g为七种由短周期元素构成的微粒,它们都有10个电子,其结构特点如下:
|
微粒代码 |
a |
b |
c |
d |
e |
f |
g |
|
原子核数 |
单核 |
单核 |
双核 |
多核 |
单核 |
多核 |
多核 |
|
带电荷数 (单位电荷) |
0 |
1+ |
1- |
0 |
2+ |
1+ |
0 |
其中b的离子半径大于e的离子半径;d是由极性键构成的四原子极性分子;c与f可形成两个共价型g分子。
试写出:
(1)a微粒的核外电子排布式
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为 > (用化学式表示)
(3)d溶于水的电离方程式
(4)g微粒所构成的晶体类型属 (5)c微粒是 ,f微粒是
(用化学式表示)
26.智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘。
(1)试配平该反应的化学方程式,并用短线标出电子转移方向及总数
NaIO3 + NaHSO3→ NaHSO4+ Na2SO4+ I2+ H2O
(2)已知含氧酸盐的氧化作用随溶液酸性的加强而增强,在制备试验时,定时取样,并用酸化的氯化钡来检测SO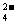 离子生成的量,发现开始阶段反应速度呈递增的趋势,试简述这变化趋势发生的原因:
离子生成的量,发现开始阶段反应速度呈递增的趋势,试简述这变化趋势发生的原因:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com