
9.FeS2在空气中充分燃烧的化学方程式为4FeS2 + 11O2 2Fe2O3 + 8SO2,若agFeS2在空气中充分燃烧,并转移N个电子,则阿伏加德罗常数(NA)可表示为
A.120N/a B.120a/11N C.11a/120N D.120N/11a
8.为提纯下列物质(括号内为少量杂质),所选用的除杂试剂与主要分离方法都正确的是
|
|
不纯物质 |
除杂试剂 |
分离方法 |
|
A |
苯(甲苯) |
KMnO4(酸化),NaOH溶液 |
分液 |
|
B |
NH4Cl溶液(FeCl3) |
NaOH溶液 |
过滤 |
|
C |
乙酸乙酯(乙酸) |
KOH溶液,水 |
分液 |
|
D |
苯(苯酚) |
浓Br2水 |
过滤 |
7.NA表示阿伏加德罗常数,下列说法正确的是
A.电解CuCl2溶液,阴极析出16g铜时,电极上转移的电子数为NA
B.标准状况下,22.4L氖气中含有NA个氖原子
C.SiO2晶体中每摩尔硅原子可与氧原子形成2NA个共价键
D.2L 1mol/L (NH4)2SO4的溶液中含有4NA个铵根离子
6.下列对实验仪器名称的标注或实验操作,正确的是

5.下列离子方程式正确的是
A.澄清石灰水中滴加稀硝酸:
Ca(OH)2 + 2H+
 Ca2+
+ 2H2O
Ca2+
+ 2H2O
 B.用Pt电极电解饱和氯化镁溶液:
B.用Pt电极电解饱和氯化镁溶液:
2Cl-+2H2O 2OH-+H2↑+Cl2↑
C.向FeBr2溶液中通入过量氯气:
2 Fe2+ + Cl2
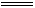 2Fe3+ + 2Cl-
2Fe3+ + 2Cl-
D.向NaOH溶液中滴加同浓度的少量Ca(HCO3)2溶液:
Ca2+ + 2HCO3- +2OH- 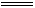 CaCO3
↓+ CO32-+ 2H2O
CaCO3
↓+ CO32-+ 2H2O
4.某溶液中可能存在Br-、CO32-、SO32-、Al3+、I-、Mg2+、Na+等7种离子中的几种。现取该溶液进行实验,得到如下现象:
①向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出;
②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成;
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。
据此可以推断:该溶液中肯定不存在的离子是
A.Al3+、Mg2+、I-、SO32- B.Mg2+、Na+、CO32-、I-
C.Al3+、Na+、SO32-、I- D.Al3+、CO32-、Br-、SO32-
3.常温下,下列各组物质不能用一种试剂通过化学反应区别的是
A.MnO2 CuO FeO B.Na2CO3 NaHCO3 K2CO3
C.AgNO3 KNO3 Na2CO3 D.(NH4)2SO4 K2SO4 NH4Cl
2.接触法生产H2SO4过程,对废气、废水、废渣、“废热”的处理正确的是
①尾气用氨水处理;
②污水用石灰乳处理;
③废渣用来造水泥,炼铁;
④设置“废热”锅炉产生蒸气,供热或发电
A.只有①② B.只有①③④ C.只有①②③ D.全部
1.下列说法正确的是
.. A.NaCl溶液、MgCl2溶液、KNO3溶液、Al2(SO4)3溶液可以用一种试剂加以区别
B.合成氨工业与接触法制硫酸中SO2催化氧化的过程中都采用了高压的生产条件
C.在医院中为酸中毒病人输液不应采用0.9%氯化铵溶液
D.汽车排放的尾气中含有氮氧化物的主要原因是汽油燃烧不充分引起的
29.(14分)将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L。请回答:
(1)NO的体积为 L,NO2的体积为 L。
(2)待产生的气体全部释放后,向溶液加入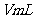
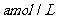 的NaOH溶液,恰好使溶液中的
的NaOH溶液,恰好使溶液中的 全部转化成沉淀,则原硝酸溶液的浓度为
mol/L。
全部转化成沉淀,则原硝酸溶液的浓度为
mol/L。
(3)欲使铜与硝酸反应生成的气体在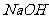 溶液中全部转化为
溶液中全部转化为 ,至少需要30%的双氧水
g。
,至少需要30%的双氧水
g。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com