
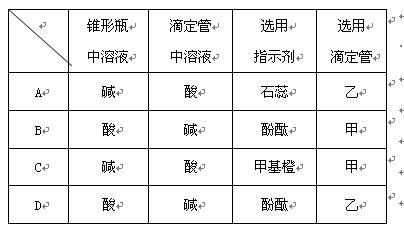
11.用已知物质的量浓度的NaOH溶液测定某H2SO4溶液的浓度,滴定管如图甲、乙所示。从下表中选出的正确组合是

10.25℃时,0.1mol·L-1的某碱MOH溶液pH=13,将它和某一元酸HA的溶液等体积混合,混合后的溶液恰好为中性。下列判断正确的是
A.HA溶液的pH.一定为1 B.盐MA可能水解
C.HA物质的量浓度一定为O.1 mol·L-1 D.混合后的溶液中c(M+)一定等于c(A-)
9.向一种溶液中滴加另一种溶液后,溶液的颜色不发生变化的是
A.碳酸钠溶液中滴加稀硫酸
B.氯化铁溶液中滴加硫氰化钾溶液
C.碘水中滴加淀粉碘化钾溶液
D.酸性高锰酸钾溶液中滴加亚硫酸钠溶液
8.常温下,测得某无色溶液中由水电离出的C(H+)=1×10-13mol·L-1,则该溶液中一定能共存的离子组是
A.AlO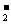 、NO
、NO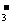 、Na+、Cl- B.Mg2+、SO
、Na+、Cl- B.Mg2+、SO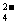 、Na+、CIO-
、Na+、CIO-
C.Fe3+、NO-3、K4、SO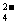 D.Ba2+、K+、NO
D.Ba2+、K+、NO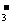 、Cl-
、Cl-
7.下列离子方程式中,正确的是
A.在氯化亚铁溶液中通入氯气 Fe2++Cl2==Fe3++2C1-
B.三氯化铁溶液跟过量氨水反应Fe3++3NH3·H2O==Fe(OH)3↓+3NH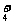
C.碳酸氢钙溶液跟稀硝酸反应Ca(HCO3)2+2H+==Ca2++2H2O+2CO2↑
D.偏铝酸钠的水溶液显碱性:AlO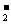 +2H2O
+2H2O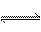 Al(OH)3↓+OH-
Al(OH)3↓+OH-
6.阿伏加德罗常数约为6.02×1023mol-1,下列说法中正确的是
A.标准状况下,1.12L的SO3所含的原子数约为0.2 × 6.02 ×1023
B.1molMgCl2中含有的离子数约为2 × 6.02× 1023
C.1.8g的NH+4离子中含有的电子数约为6.02×1023
D.2.4g金属镁变为镁离子时失去的电子数约为O.1×6.02×1023
5.下列实验方案合理的是
A.用饱和碳酸钠溶液除去乙酸乙酯中混有的乙酸、乙醇杂质
B.用加入浓溴水的方法分离甲苯和苯酚的混合液
C.用点燃的方法来除去二氧化碳中混有的少量的一氧化碳
D.用过滤的方法除去苯酚中的三溴苯酚
4.已知H2(g)+Cl2(g) 2HCl(g);△H=-184.6
kJ·mol-1,则犀应HCl(g)=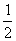 H2(g)+
H2(g)+ 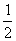 Cl2(g)的△H为
Cl2(g)的△H为
A.+1 84.6 kJ·mol-1 B.-9 2.3 kJ·mol-l
C.+92.3 kJ·mol-1 D.-369.2 kJ·mol-1
3.近代化学常用CaH2作生氢剂,其化学方程式为.CaH2+2H2O=Ca(OH)2+2H2↑,其中水的作用是
A.氧化剂 B.还原剂
C.溶剂 D.既是氧化剂又是还原剂
2.下列关于某些社会热点问题的说法中,不正确的是
A.光化学烟雾的产生与碳氢化合物、氮氧化物的排放有关
B.禁止使用含铅汽油是为了提高汽油的燃烧效率
C.臭氧空洞的形成与氟氯烃或氮氧化物泄漏到大气中有关
D.甲醛是某些劣质装饰板材释放的常见污染物之一
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com