
21.(9分)
大气为地球上各种生物的生存提供了条件。但是,随着工业和交通运输迅速发展,城市人口高度集中,人类向大气中大量排放烟尘和有害气体等,正在对大气造成污染。我国某工业城市的“空气质量日报”显示,该城市的空气受到一定程度的污染。某研究性学习小组对该城市的空气污染进行了下列研究。
(1)小组内一同学初步分析得出,该城市空气污染的主要原因有
A.使用石油液化气
B.燃烧含硫煤
 C.粉尘污染三个。另一同学认为还有一个不可排除的原因是:
C.粉尘污染三个。另一同学认为还有一个不可排除的原因是:
D.______________________________________。
研究性学习小组就造成该城市空气污染的最主要原因调查了该市100名市民和100位环保部门人士。调查结果如下图所示:
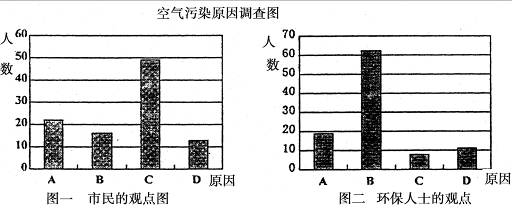
(1)从环保人士的观点上分析,你认为造成该城市空气污染的主要有害成分是_______________ (用化学式表示)。
(2)空气污染易形成酸雨。研究性学习小组对该城市的雨水进行了采样与分析,刚采集时测得pH为4.82,放在烧杯中经2 h后,再次测得pH为4.68。对此,你的合理解释是___________________。
(3)研究性学习小组同学取空气(含氮气、氧气、二氧化碳、二氧化硫等)10.0 L_(已折算成标准状况),缓慢通过足量溴水,在所得溶液中加入过量的氯化钡溶液,产生白色沉淀,将沉淀洗涤、干燥,称得其质量为0.0233g。试回答该白色沉淀的化学式为____________,通过计算得该空气中主要有害气体成分的体积分数为______________。
(4)该小组同学提出下列措施以减少空气污染的主要有害成分排放量,你认为合理的是____________ (填序号)。
①用天然气代替煤炭做民用燃料 ②改进燃煤技术,减少煤的用量
③工厂生产时将燃煤锅炉的烟囱造得更高 ④燃煤中加入适量石灰石后使用
20.(10分)
发射航天火箭常用氮的氢化物肼(N2H4)作燃料。试回答下列有关问题:
(1)写出N2的电子式
(2)液态NH3类似H2O,也能微弱电离且产生电子数相同的两种离子,则液态NH3电离方程式为_________________________________。
(3)25℃时,0.1 mol·L-1 NH4NO3溶液中水的电离程度_________ (填“大于”、“等于“或“小于”)0.1 mol·L-l NaOH溶液中水的电离程度。若将0.1mol·L-1NaOH和0.2mol·L-1 NH4NO3两溶液等体积混合,所得溶液中离子浓度由大到小的顺序为___________。
(4)在结构上N2H4和NH3的关系有如H2O2和H2O的关系。N2H4能发生下列反应:
N2H4+H3O+==N2H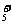 +H2O N2H4+H2O
+H2O N2H4+H2O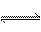 N2H
N2H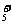 +OH-
+OH-
N2H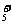 +H2O
+H2O N2H
N2H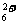 +OH- N2H
+OH- N2H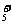 + H2O
+ H2O N2H4+H3O+
N2H4+H3O+
据此可得出的结论是______________________。
A.肼水解显酸性 B.肼在水中电离出H+离子
C.肼是二元弱碱 D.肼是二元弱酸
(5)完成下列反应方程式并配平:
______NH3+______NaClO==_________NaCl+_______N2H4+_____ _____
(6)发射火箭时胼(N2+H4)为燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。已知4gN2H4(g)在上述反应中放出71kJ的热量,写出该反应的转化学方程式_____________。
19.(9分)
已知X是一种盐,H是常见金属单质,F、I是常见非金属单质,E、G都是工业上重要的碱性物质,它们有下图所示的关系。
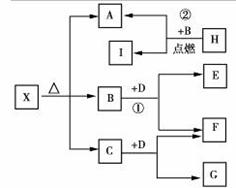
试回答下列问题:
(1)G的化学式为:_______________。
(2)写出下列反应的化学方程式
①__________________________________
②_________________________________。
(3)X在医药上用作解酸剂,与盐酸作用时,生成B的物质的量与消耗盐酸的物质的量之比 为3∶8,则X的化学式为:_________;X与盐酸反应的化学方程式为:____________。
18.(15分)
某校课外实验小组同学设计了如图实验装置进行实验(夹持装置已略去)。
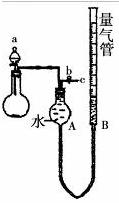
(1)该小组同学用该装置进行“乙炔的制取及其燃烧性质的验、证”实验。
①仪器a的名称是____________,实验开始时使用该仪器的操作方法是_____________;
②点燃乙炔前,需要验纯。简述验纯的操作方法:______________________。
③在导管口c处点燃乙炔,观察到的现象是
(2)该装置还可用于制取并收集少量其他气体。请帮助该小组同学完成下表。
|
制取的气体 |
药品 |
化学方程式 |
|
O2 |
_________、___________ |
_________________ |
|
________________ |
NaOH浓溶液、Al |
_________________ |
(3)某同学用该装置进行实验,确定某饱和醇的结构。反应前,先对量气管进行第一次凑数;反应后,待装置温度冷却到室温,再对量气管进行第二次读数(表中读数已折合成标准状况下的数值)。实验数据记录如下:
|
|
饱和醇的质量 |
金属钠的质量 |
量气管最一次读数 |
量气管第二次读数 |
|
① |
0.62g |
5.0g(足量) |
40mL |
264mL |
|
② |
0.31g |
2.5g(足量) |
40mL |
152mL |
已知该饱和醇的相对分子质量为、62。根据上述数据可确定该.饱和醇的结构式为________。
17.(7分)
在足量的稀氯化亚铁溶液中,加入1-2滴液溴,振荡后溶液变为黄色。
(1)甲同学认为这不是发生化学反应所致,使溶液变黄色的物质是:________ (填粒子的化学式,下同);乙同学认为这是发生化学反应所致,使溶液变黄色的物质.
(2)现提供以下试剂:
A.酸性高锰酸钾溶液 B.氢氧化钠溶液 C.四氯化碳 D.硫氰化钾溶液
根据所学知识判断,___________同学(填甲或乙)的推断是正确的口用两种方法加以验证,写出选用的试剂编号及实验中观察到的现象:
|
|
选用试剂 |
实验现象 |
|
第一种方法 |
|
|
|
第二种方法 |
|
|
16.含8.0g NaOH的溶液中通入一定量H2S后,将得到的溶液低温小心蒸干,称得无水物7.9g,则该无水物中一定含有的物质是
A.Na2S B.NaHS C.Na2S和NaHS D.NaOH和NaHS
第二卷
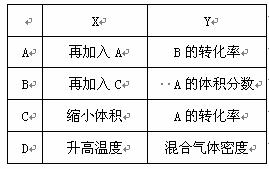
15.在一密闭容器中通入A、B两种气体,一定条件下发生如下反应:
2A(g)+B(g) 2C(g);△H<0
2C(g);△H<0
达到平衡后,只改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是
14.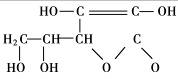 2006年3月2日英国《泰晤士报》报道指出:汽水中如果同时含有苯甲酸钠(防腐剂,C6H5COONa)与维生素C(抗氧化剂,结构式如图)可能会相互作用生成苯。下列说法不正确的是
2006年3月2日英国《泰晤士报》报道指出:汽水中如果同时含有苯甲酸钠(防腐剂,C6H5COONa)与维生素C(抗氧化剂,结构式如图)可能会相互作用生成苯。下列说法不正确的是
A.苯是非极性分子
B.苯在一定条件下能发生取代反应和加成反应
C.维生素C在碱性溶液中能稳定存在
D.维生素C可溶于水
13.下列叙述正确的是
A.分子晶体中都存在共价键
B.F2、C12、Br2、I2的熔沸点逐渐升高与分子间作用力有关
C.含有极性键的化合物分子一定不含非极性键
D.只要是离子化合物,其熔点一定比共价化合物的熔点高
12.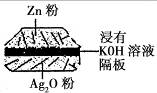 如图:一种微型钮扣电池,其电极材料分别为Ag2O和Zn,电解质溶液是KOH 溶液。负极的反应式:Zn一2e-+2OH-==ZnO+H2O,该电池总反应式为:Zn+Ag2O==ZnO+2Ag。 根据以上提供的资料,判断下列说法正确的是
如图:一种微型钮扣电池,其电极材料分别为Ag2O和Zn,电解质溶液是KOH 溶液。负极的反应式:Zn一2e-+2OH-==ZnO+H2O,该电池总反应式为:Zn+Ag2O==ZnO+2Ag。 根据以上提供的资料,判断下列说法正确的是
A.正极的反应式:Ag2O+2e-+H2O==2Ag+2OH-
B.放电时负极附近溶液的pH不变
C.放电时每消耗6.5g Zn,转移电子0.1mol
D.放电时溶液中阴离子向正极方向移动,阳离子向负极方向移动
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com