
(五)问题和讨论:
实验完成后,老师评议说:按上述实验设计,即使G中反应完全、D中吸收完全,也不会得出正确的结果。经讨论,有同学提出在B与G之间加入一个装置。再次实验后,得到了较正确的结果。那么,原来实验所测得的钢的质量分数偏小的原因可能是_______________-,在B与G之间加入的装置可以是__________________,其中盛放的药品是__________________。
(四)计算:样品中铜的质量分数=________________(用含W、m1、m2的代数式表示)
(三)实验内容:
|
实验过程 |
实验现象 |
有关化学方程式 |
|
在C中加入样品标本W克,D中装入精品后并称量为m克。连接好仪器后,检查气密性 |
--------------------------------- |
---------------------------- |
|
打开A的活塞,慢慢洋加溶液。 |
|
|
|
对G进行加热。当G中药品充分反应后。关闭A的活塞。停止加热: |
|
|
|
冷却后,称量D的质量为m2克。 |
---------------------------------- |
------------------------------- |
(二)实验用品:仪器:天平、分液漏斗、锥形瓶、硬玻璃管、干燥管、酒精灯、洗气瓶等
药品:红褐色铜粉(含炭)样品、过氧化氢溶液、二氧化锰、碱石灰。浓硫酸等
(一)实验目的:__________________________________。
21.(12分)回答下列问题:
(1)下列仪器中:①普通漏斗 ②天平 ③蒸馏烧瓶 ④容量瓶 ⑤燃烧匙 ⑥滴定管 ⑦分液漏斗,常用于物质分离的是___(填编号),其中根据物质沸点不同分离物质的仪器是______(填编号)。
(2)实验室有贮存以下物质的方法:A.少量白磷贮存在水中;B.碳酸钠溶液贮存在带玻璃塞的玻璃瓶中;C.少量金属钠贮存在酒精中;D.浓硝酸贮存在棕色的细口玻璃瓶中。其中正确的_______________________(填编号)。
(3)下列实验操作错误的是___________
A.检测溶液pH的操作是:将湿润的pH试纸置于表面皿上,用玻璃棒蘸取溶液,点在pH试纸的中部,与对应的标准比色卡进行比较。
B.容量瓶检漏的操作是:在容量瓶中注入适量的水,塞上玻璃瓶塞,左手五指托住瓶底,右手食指顶住瓶塞,反复倒置,观察是否漏水。
C.用酸滴定碱的操作是:左手摇动锥形瓶,右手控制活塞,两眼注视滴定管中溶液液面的变化。
D.观察钾元素焰色反应的操作是:将铂丝放在稀盐酸中洗涤,然后蘸取固体氯化钾,置于煤气灯的火焰上进行灼烧,透过蓝色钴玻璃进行观察。
22.(15分)
电镀厂曾采用有氰电镀工艺,由于排放的废水中含有的剧毒CN-离子,而逐渐被无氰电镀工艺替代。处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2。环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并测定CN-被处理的百分率。
将浓缩后含CN-离子的污水与过量NaClO溶液的混合液200 mL(其中CN-的浓度为0.05 mol·L-1)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。
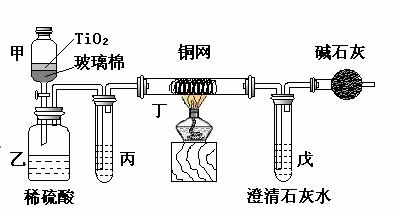
(1) 甲中反应的离子方程式为_______________;乙中反应的离子方程式为________
(2) 乙中生成的气体除N2和CO2外,还有HCl及副产物Cl2等,上述实验是通过测定二氧化碳的量来确定对CN-的处理效果。丙中加入的除杂试剂是_________________(填字母)
a.饱和食盐水 b.饱和NaHCO3溶液
c.浓NaOH溶液 d.浓硫酸
(3)丁在实验中的作用是__________________________________
(4)戊中盛有足量的石灰水,若实验中戊中共生成0.82 g沉淀,则该实验中测得CN-被处理的百分率等于_________________。请说明该测得值与实际处理的百分率相比偏高还是偏低?简要说明理由______________________________。
23.(18分)
某课外活动小组加热炭粉(过量)和氧化铜的混合物,再用右图装置,对获得的铜粉(含炭)样品进行实验。图中铁架台等装置已略去。请你帮助他们完成下列实验报告。

20.鉴别SO2和CO2,可将它们分别通入( )
A.盛有澄清石灰水的洗气瓶
B.盛有品红溶液的洗气瓶
C.盛有氯化钡溶液的洗气瓶
D.盛有溴水的洗气瓶
第二卷(非选择题,共70分)
19.下列比较正确的是( )
A.熔沸点高低: PH3<AsH3< NH3
B.离子半径大小:Br-<Mg2+<Cl-<F-
C.分散质微粒直径大小:Fe(OH)3胶体>NaCl溶液
D.酸性强弱: CH3COOH> H2SiO3> H2CO3
18.浓度为0.50mol·L-1的某金属阳离子Mn+的溶液10.00mL,与0.40mol·L-1的NaOH溶液12.50mL完全反应,生成沉淀,则n等于( )
A 1 B 2 C 3 D 4
17.在一定体积某浓度的Ba(NO3)2溶液中,逐滴加入pH=1的稀硫酸至溶液中的Ba2+恰好完全沉淀时,测得溶液pH=2,若忽略两溶液混合时的体积变化,则稀硫酸的体积与Ba(NO3)2溶液的体积比是( )
A.10∶1 B.1∶10 C.9∶1 D. 1∶9
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com