
26.(9分)
(1)航天飞机曾用金属铝粉和高氯酸铵混合物作为固体燃料。加热铝粉使其氧化并放出大量热量,促使混合物中另一种燃料分解。m mol高氯酸铵分解时除产生2m mol水蒸气和m mol氧气外,其他组成元素均以单质形式放出,因而产生巨大的推动力。
写出其中涉及到的化学方程式:
;
。
(2)高氯酸铵作为火箭燃料的重要氧载体。高氯酸铵在高压、450℃的条件下迅速分解生成水蒸气、氮气、氯化氢和氧气。
①写出此反应的化学方程式 。
②反应中生成的氧化产物与还原产物的物质的量之比是 ,
每分解1mol高氯酸铵,转移的电子数目是 。
25.(10分)短周期元素A、B、C、D中,0.5molA元素的离子得到的6.02×1023个电子后被还原为中性原子;0.4克A的氧化物恰好与100mL 0.2mol/L的盐酸完全反应;A元素原子核内质子数与中子数相等。B元素原子核外电子数比A元素原子核外电子数多1;C-离子核外电子层数比A元素的离子核外电子层数多1;D元素原子最外层电子数是次外层的2倍。请填写下列空格:
(1)推断A、B、C、D四种元素的符号A ;B ;C ;D ;
(2)C-1离子的原子结构示意图 ;
(3)D元素的最高价氧化物的结构式是: ;
(4)C、D元素组成的物质,分子内含有 键(填“极性”或“非极性”,下同),其分子为 分子。
(5)用电子式表示A、C两元素形成的化合物: 。
24.(13分)已知主族元素X、Y、Z、W是分布于元素周期表中三个短周期里的非金属元素,其原子序数依次增大。W原子的质子数是Y原子质子数的两倍,X原子与W原子的最外层电子数之和是Y和Z原子的质子数之和的1/3。Y的氢化物分子中有三个共价键。
(1)X、Y、Z、W的元素名称分别是 、 、 、 。
(2)Y的氢化物分子属于 分子(填“极性”或“非极性”),Y的氢化物的沸点比相邻同主族元素氢化物的沸点高,其原因是 。Y的氢化物与质子反应的产物的电子式为 ,此产物的空间形状呈 。
(3)由以上任意三种元素组成的化合物中,其水溶液显酸性的有(填写化学式) 、 、 。
(4)我国材料学家已成功制备了W元素与Y元素组成的耐高温的新型材料W3Y4。工业上可用W的氢化物与Y的氢化物反应制得该耐高温化合物和氢气,此反应的化学方程式为 。
23.(10分)四氯化钛(TiCl4)是工业上制备金属钛的重要原料。常温下,它是一种极易水解的无色液体,沸点为136.4℃。工业制备TiCl4和钛的反应分布为:
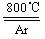 TiO2
+2C+2Cl2
TiO2
+2C+2Cl2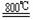 TiCl4 +2CO ;TiCl4
+2Mg
Ti + 2MgCl2
TiCl4 +2CO ;TiCl4
+2Mg
Ti + 2MgCl2
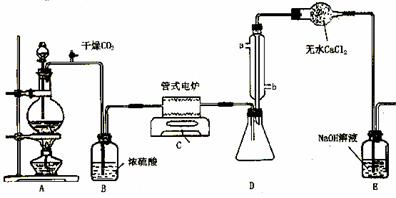
下图是实验室制备TiCl4的反应装置,主要操作步骤:
①连接好整套装置,在通Cl2前先通入CO2气体并持续一段时间;
②当锥形瓶中TiCl4的量不再增加时,停止加热,从侧管中改通CO2气体直到电炉中的瓷管冷却为止;
③将TiO2、炭粉混合均匀后,装入管式电炉中;
④ 将电炉升温到800℃,一段时间后改通Cl2,同时在冷凝管中通冷凝水。
试回答下列问题:
⑴ 正确的操作顺序为(填序号)___________________________ 。
⑵ 装置A中的反应的离子方程式为__________________________________ 。
⑶ 操作①的目的是_________________________________ 。
⑷ 装置D中冷凝管进水口的位置是(填a或b)__________ ,
装置E的作用是___________________________________________________ 。
⑸ TiCl4露置于空气中极易水解,其化学方程式可表示为_____________________ 。
⑹ 工业上常用金属镁在800℃高温和氩气氛围中还原TiCl4的方法制备钛,
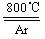 TiCl4
+2Mg
Ti + 2MgCl2 ,氩气的作用为__
。
TiCl4
+2Mg
Ti + 2MgCl2 ,氩气的作用为__
。
22.(10分)硫酸工厂周围的空气中有较多的二氧化硫。某研究学习小组为了测定空气中二氧化硫的体积分数设计了如下两个方案:
方案一:取标准状态下的空气V L(内含N2、O2、CO2、SO2等),缓慢通过足量溴水,在所得的溶液中加入过量的氯化钡溶液后,过滤,将沉淀洗涤、干燥,称得其质量为m g.请回答:
(1)加入过量的氯化钡溶液的目的是 。
(2)过滤后,若在滤液中加入硫酸钠溶液,有白色沉淀产生,说明 。
(3)过滤后,一般要用蒸馏水洗涤沉淀2-3次,以除去附在沉淀上的可溶性物质。请说明应通过什么方法验证可溶物质是否已被除尽(要求:实验过程、使用的试剂、现象及结论)。
__________________________________________________________________________________________________________________________________________________________________________
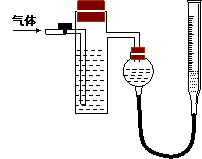 方案二:采用如右图所示装置,装置中反应管内装有碘的淀粉溶液。按设计意图,将空气(内含N2、O2、CO2、SO2等)通过此装置时,其中的SO2被吸收,量气管内增加的体积为其余气体的体积。
方案二:采用如右图所示装置,装置中反应管内装有碘的淀粉溶液。按设计意图,将空气(内含N2、O2、CO2、SO2等)通过此装置时,其中的SO2被吸收,量气管内增加的体积为其余气体的体积。
(4)反应管内溶液蓝色消失后,没有及时停止通气,则测得的SO2的含量 (选填“偏高”“偏低”或“不受影响:)。
(5)反应管内的碘的淀粉溶液可以用下列的 (填代号)代替:
A.NaOH溶液 B.酸性KMnO4溶液 C.Na2SO3溶液 D.BaCl2溶液
(6)若碘溶液体积为VamL ,浓度为c mol·L-1。剩余气体的体积为VbmL(已折算成标准状态下的体积)。用c、Va、Vb表示SO2的体积分数为:
(7)研究小组经过讨论发现方案二的设计中有一个明显的缺陷影响了测定结果(不属于操作错误),你认为是 。
21.(8分)根据溴的性质,填写下列表格中关于液溴保存方法的选择及有关原因的解释:
①广口瓶②细口瓶③玻璃塞④橡皮塞⑤水封⑥煤油封⑦棕色瓶⑧无色瓶
|
|
选择保存方法 |
解释 |
|
(1) |
|
|
|
(2) |
|
|
|
(3) |
|
|
|
(4) |
|
|
20. 如图是氯化铯晶体的晶胞,已知晶体中2个最近的Cs+离子核间距离为a cm,氯化铯的式量为M,NA为阿氏常数,则氯化铯晶体的密度为
如图是氯化铯晶体的晶胞,已知晶体中2个最近的Cs+离子核间距离为a cm,氯化铯的式量为M,NA为阿氏常数,则氯化铯晶体的密度为
|
|
|
|
A.-- g/cm3 B.-- g/cm3 C.-- g/cm3 D.-- g/cm3
第二卷
19.在反应:11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4 中7.5mol CuSO4可氧化的P原子的物质的量为
A.1.5mol B.5.5mol C.3mol D.2.5mol
18.有某硫酸和硝酸的混合溶液20mL,其中含有硫酸的浓度为2mol·L-1,含硝酸的浓度为
1mol·L-,现向其中加入0.96g铜粉,充分反应后(假设只生成NO气体),最多可收集到标况下的气体的体积为
A.89.6mL B.112mL C.168mL D.224mL
17.下列实验测量数据记录正确的是
A.用pH试纸测得0.100mol/mol醋酸的pH为3.02
B.用量筒测得排水法收集制得的氢气体为50.28mL
C.用滴定管测得中和滴定所消耗的标准溶液体积为20.32mL
D.用托盘天平称得2.50g胆矾受热充分失水后,固体质量减轻0.90g
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com