
6.常温下向10mL0.01mol·L-1BaCl2溶液中加入10mL0.01mol·L-1H2SO4溶液,反应后溶液的pH为 ( )
A.2 B.3 C.5 D.7
5.燃烧下列某混合气体,所产生的H2O的质量一定大于燃烧相同质量丙烯所产生的H2O的质量的是 ( )
A.丁烯、丙烯 B.乙炔、乙烯 C.乙烷、环丙烷 D.丙炔、丁烷
4.下列叙述中,正确的是 ( )
A.化合反应一定是氧化还原反应,肯定有元素被氧化,同时有元素被还原
B.有单质参加或生成的反应一定属于氧化还原反应
C.比较难失电子的原子,获得电子的能力一定强
D.元素由化合态变成游离态时,它可能被氧化,也可能被还原
3.下列现象或新技术应用中,不涉及胶体性质的是 ( )
A.在饱和氯化铁溶液中逐滴加NaOH溶液,产生红褐色沉淀
B.使用微波手术刀进行外科手术,可使开刀处的血液迅速凝固而减少失血
C.清晨,在茂密的树林中,常常可以看到从枝叶间透过的一道道光柱
D.肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗
2.为延长方便食品的保质期,防止受潮和氧化,可以在食品袋中置入用透气材料包装的干燥剂和抗氧化剂,下列各组物质中,可被选用的一组是 ( )
A.CuSO4·5H2O、C12H12O11 B.硅胶、FeSO4
C.C6H5OH、CaO D.NaCl、FeSO4
1.某气体在靠近地面的空气中若浓度稍大是一种污染物,而在高空形成的气层却对地球生物有保护作用,该气体是下列的 ( )
A.NO B.O3 C.CO D.氟氯烃
20.(15分)为测定碳酸钙纯度(设含杂质SiO2),学生设计了如下几个实验方案,请回答每个方案中的问题。
[方案I](1)称取碳酸钙样品 M g;(2)加入过量盐酸;(3)收集并测定生成的气体体积 V mL。
问题:如果称量样品时,砝码底部有一处未被实验者发现的残缺,那么测定的碳酸钙的纯度会 (偏高、偏低、无影响)
[方案II](1)称取碳酸钙样品
M g;(2)用c mol/L 盐酸 V mL(过量)溶解样品;(3)取溶解后的溶液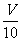 mL,用C′mol/L NaOH溶液滴定,恰好用去V′mL。
mL,用C′mol/L NaOH溶液滴定,恰好用去V′mL。
问题1:列出本实验中所用到的仪器名称(除铁架台及附件、烧杯之外)
。
问题2:加盐酸后是否需要滤出SiO2后再用NaOH滴定 (填选项编号)。
A.需要 B.不需要 C.均可
问题3:碳酸钙纯度计算公式 。
[方案III](1)称取碳酸钙样品 M g;(2)高温(1000℃)煅烧直至质量不再发生变化,冷却后称量,质量为M′g。
问题1:为什么要煅烧至1000℃且“直至质量不再改变”? ;
问题2:本方案中的“冷却”应如何操作 。
[方案IV](1)称取碳酸钙样品 M g;(2)加入足量Cmol/L盐酸V mL使之完全溶解;(3)过滤并取滤液;(4)在滤液中加入过量C′mol/L Na2CO3溶液V′mL;(5)将步骤(4)中的沉淀滤出、洗涤、干燥、称重为M′g。
问题1:此方案中不需要的数据是 (填选项编号)。
A.C、V B.C′、 V′ C. M′ D. M
问题2:为减少实验误差,必要的操作是 (填选项编号)。
A.精确测定Na2CO3溶液体积V′ mL
B.精确配制浓度C′mol/LNa2CO3溶液
C.将步骤(3)所得沉淀洗涤,洗涤液也应并入(4)中
D.将步骤(3)所得沉淀洗涤、干燥、称量其质量M′g备用
问题3:步骤(5)中要将沉淀进行洗涤,如果未经洗涤,则测定的碳酸钙纯度将 (偏高、偏低、无影响)。
综上所述,你认为4个方案中,最好的方案是 ,其它方案的缺点分别是:
方案IV:沉淀的洗涤、干燥、称量操作过程复杂,容易造成较大误差;
方案 ; 。
方案 ; 。
19. (6分)某研究性学习小组在整理实验室化学试剂时,发现一盛有无色溶液的试剂瓶,标签破损,如右图。某同学根据中学化学知识,对该试剂可能是什么物质的溶液进行了如下猜想和验证,选择你认为完全正确(包括猜想物质的化学式、检验需要的试剂、操作、现象及结论)的选项 (多选倒扣分)。
(6分)某研究性学习小组在整理实验室化学试剂时,发现一盛有无色溶液的试剂瓶,标签破损,如右图。某同学根据中学化学知识,对该试剂可能是什么物质的溶液进行了如下猜想和验证,选择你认为完全正确(包括猜想物质的化学式、检验需要的试剂、操作、现象及结论)的选项 (多选倒扣分)。
|
序号 |
猜想物质的化学式 |
检验需要的试剂 |
操作、现象及结论 |
|
A |
Na2SO4 |
稀盐酸、氯化钡溶液 |
取少量该溶液于试管中,滴入稀盐酸,若无明显现象,再滴入氯化钡溶液,如果产生白色沉淀,则原溶液是Na2SO4。 |
|
B |
Na2CO3 |
稀盐酸、澄清的石灰水、品红溶液 |
取少量该溶液于试管中,滴入稀盐酸,如果产生的气体不能使品红溶液褪色而能使澄清的石灰水变浑浊,则原溶液是 Na2CO3。 |
|
C |
Na2SO3 |
稀盐酸、澄清的石灰水 |
取少量该溶液于试管中,滴入稀盐酸,如果产生无色气体能使澄清的石灰水变浑浊,则原溶液一定是Na2SO3。 |
|
D |
Na2SiO3 |
过量稀盐酸 |
取少量该溶液于试管中,滴入稀盐酸,产生白色胶状沉淀,盐酸过量时沉淀溶解,则原溶液是Na2SiO3溶液。 |
|
E |
Na2S2O3 |
稀盐酸 |
取少量该溶液于试管中,滴入稀盐酸,如果溶液变浑浊(或产生淡黄色沉淀),并产生无色有剌激性气味的气体,则原溶液是Na2S2O3溶液。 |
除上述五种可能之外,写出你认为还有可能物质的化学式(1种): 。
18.(12分)A-J是中学化学中常见的几种物质,它们之间的转化关系如下图所示。已知常温下A为固体单质,B为淡黄色粉末,C、F、I为气态单质,E在常温下为液体,且E可由C、F化合生成,J可作禽流感、SARS等病毒的杀菌消毒剂。
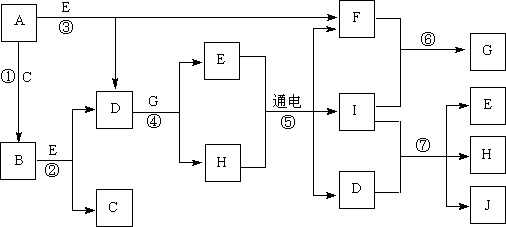
(1)写出E、B的电子式:B_______________。E 。
(2)写出反应⑦的离子方程式:_________________________________。
(3)向AlCl3溶液中加入少量固体B,写出反应的化学方程式:____________。
(4)以Pt为电极电解滴加有少量酚酞的H饱和溶液,则阳极的电极反应式为:__________________。________极(填“阴”或“阳”)附近溶液由无色变为红色。
17.(8分) 能源是人类社会发展进步的物质基础。在当代,能源同信息、材料一起构成了现代文明的三大支柱。
(1)为了降低汽车尾气对大气的污染,江苏有关部门拟用甲醇替代液化石油气作为公交车的燃料。已知:在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。请写出表示甲醇燃烧热的热化学方程式。
(2)测定工业甲醇中CH3OH的质量分数可按下法:取0.1000g工业甲醇样品,以适量H2SO4酸化后,加入20.00mL 0.2000mol/L的K2Cr2O7溶液,再用0.3000mol/L (NH4)2Fe(SO4)2标准溶液滴定,耗去此标准液20.00mL时,刚好到达滴定终点。
已知:CH3OH+Cr2O72-+8H+=CO2↑+2Cr3++6H2O
①写出H2SO4酸化的K2Cr2O7溶液与(NH4)2Fe(SO4)2溶液反应的离子方程式。
②此工业甲醇中CH3OH的质量分数为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com