
26.(3分)下列实验仪器需插入液面下的是 。
①吸取NaOH溶液滴入FeSO4溶液制Fe(OH)2时的胶头滴管;
②制备H2的简易装置中长颈漏斗的下端;
③蒸馏分离石油时,控制温度用的温度计;
④用无水乙醇与浓硫酸共热制乙烯所用的温度计;
⑤用水吸收氯化氢时,导出氯化氢的导管口;
⑥向装有BaCl2溶液的试管中滴加AgNO3溶液时的胶头滴管。
25.(10分)已知羧酸在磷的催化条件下可以和卤麦反应生成α-卤代物(与羟基相邻的碳原子上的氢原子被取代):
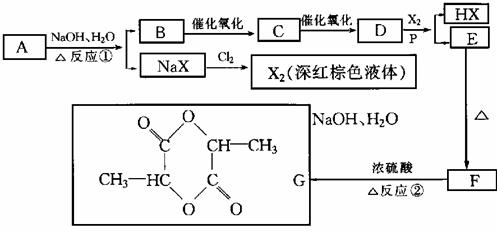
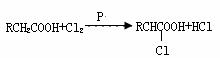
(1)写出有机物A、C、D的结构简式:
A. ,C. ,D. 。
(2)写出下列反应的化学方程式:
反应①: 。
反应② 。
24.(10分)下图中A~J分别代表相关反应中的一种物质,已知A受热分解得到相同物质的量的B、C、D(图中有部分生成物未写出)。
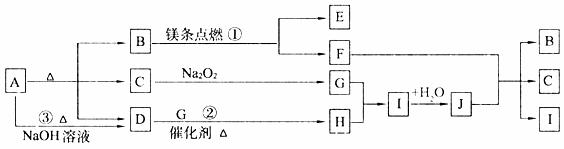
请填写以下空白:
(1)B的电子式为 ,D分子的空间构型为 。
(2)写出反应①、②的化学方程式:
① ;
② 。
(3)反应③的离子方程式为: 。
23.(6分)烃类有机物中,碳原子之间形成的共用电子对的数目就是碳原子之间形成的共价键的数目。而烃分子中每减少2个氢原子,碳原子之间就增加一个共同电子对。
请回答下列问题:
(1)每个烷烃CnH2n+2分子中,碳原子之间形成的共用电子对的数目为 (用含n的代数式表示)。
(2)每个炔烃CnH2n-2分子中,碳原子之间形成的共价键的数目为 (用含n的代数式表示)。
(3)有一种碳元素形成的单质可以看成烃分子失去全部氢原子形成的,这种单质的每个分子含有共用电子对的数目为120,则这种单质的分子式为 。
22.(7分)将2molH2O(气)和2molCO置于1L密闭容器中,在一定条件下,加热至高温,发生下列可逆反应:

 2H2O(g)
2H2(g)+O2(g),2CO(g)+O2(g)
2CO2(g)
2H2O(g)
2H2(g)+O2(g),2CO(g)+O2(g)
2CO2(g)
(1)当上述反应达到平衡时,欲求混合气体的平衡组成,则至少需要知道两种气体的平衡浓度。下列各项气体的平衡浓度可用于求混合气体的平衡组成的是 (填序号)
A.H2O、H2 B.H2、O2 C.CO2、O2 D.CO、CO2
(2)若平衡时O2和CO的物质的量分别为n(O2)=amol,n(CO)=bmol,则平衡时n(H2O)=
mol。(用含a、b的代数式表示)。
21.(5分)有X、Y、Z3种元素(X、Y、Z分别代表元素符号),原子序数均不超过20。已知:
①X+和Y-两种离子具有相同的电子层结构;
②Z元素原子核内质子数比Y元素原子核内质子数少9个;
③Y和Z两元素可以形成4核42电子的-1价阴离子。
请回答下列问题:
(1)写出X、Y、Z三种元素的元素符号:X ,Y ,Z 。
(2)写出X、Y两种元素最高价氧化物对应水化物间相互反应的离子方程式:
20.有某硫酸和硝酸的混合溶液20mL,其中含有硫酸的浓度为2mol·L-1,含硝酸的浓度为1mol·L-,现向其中加入0.96g铜粉,充分反应后(假设只生成NO气体),最多可收集到标况下的气体的体积为 ( )
A.89.6mL B.112mL C.168mL D.224mL
第二卷(非选择题 共60分)
19.分析某种煤气的体积组成如下:H250%、CH430%、CO10%、N26%、CO24%。
已知:H2(g)+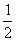 O2(g)=H2O(1);△H=-285.8kJ·mol-1
O2(g)=H2O(1);△H=-285.8kJ·mol-1
CO(g)+ 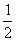 O2(g)=CO2(g); △H=-282.6kJ·mol-1
O2(g)=CO2(g); △H=-282.6kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(1); △=-890.3kJ·mol-1
则在标准状况下,224L该种煤气燃烧时放出的热量为 ( )
A.1461.7kJ B.4382.5kJ C.4665.1kJ D.5811.5kJ
18.在一定温度下,向饱和Na2SO4溶液中加入ag无水Na2SO4粉末,搅拌、静置后析出bgNa2SO4·10H2O晶体,则bg-ag的值是 ( )
A.原饱和溶液中减少的Na2SO4的质量
B.原饱和溶液中失去的水的质量
C.原饱和溶液中失去的水和NaSO4的质量总和
D.析出晶体中含有的Na2SO4的质量
17.目前,科学家正在研究开发一种高能电池--钠硫电池,它以熔融的钠、硫为两极,以Na+导电的β-Al2O3陶瓷作固体电解质,反应式如下: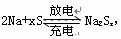 ,以下说法正确的是 ( )
,以下说法正确的是 ( )
A.放电时,Na作正极,S极发生还原反应
B.充电时,钠极与外电源的正极相连
C.充电时,阳极发生的反 应为xS2--2e-=xS
D.若放电时有0.2mol电子转移,同时反应掉的金属钠为4.6g
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com