
23.有X、Y、Z三种元素,已知:①X2-、Y-均与Y的气态氢化物分子具有相同的电子数;②Z与Y可组成化合物ZY3,ZY3溶液遇苯酚呈紫色。
请回答:
(1)Y的最高价氧化物对应水化物的化学式是 。
(2)将ZY3溶液滴入沸水可得到红褐色液体,将ZY3溶液滴入沸水可得到红褐色液体,反应的离子方程式是: ,此液体具有的性质是 (填写序号字母)。
a.光束通过该液体时形成光亮的“通路”
b.插入电极通直流电后,有一极附近液体颜色加深
c.向该液体中加入硝酸银溶液,无沉淀产生
d.将该液体加热、蒸干、灼烧后,有氧化物生成
(3)X单质在空气中燃烧生成一种无色有刺激性气味的气体。
①已知一定条件下,每1 mol该气体被O2氧化放热98.0 kJ。若2 mol该气体与1 mol O2在此条件下发生反应,达到平衡时放出的热量是176.4 kJ,则该气体的转化率为: 。
②原无色有刺激性气味的气体与含1.5 mol Y的一种含氧酸(该酸的某盐常用于实验室制取氧气)的溶液在一定条件下反应,可生成一种强酸和一种氧化物,若有1.5×6.02×1023个电子转移时,该反应的化学方程式是: 。
22.将一定量的NaOH和NaHCO3的混合物放在密闭的容器中加热,充分反应后生成CO2的体积为V1(V1≠0)。将反应后的固体残渣Y与过量的稀盐酸反应,又生成V2体积的CO2(V1、V2)均为标准状况的体积)。若2 V1=V2,则原混合中NaOH和NaHCO3的物质的量之比为
[此题仅普通班做]21.某化学兴趣小组的同学为模拟工业制造硫酸的生产过程,设计了如图所示的装置,请根据要求回答问题: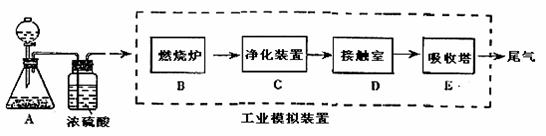
(1)装置A用来制取氧气,写出相应的化学方程式____________ ______________;
(2)燃烧炉内放一定量黄铁矿粉末,在高温条件下和A装置制出的氧气充分反应,在该反应中____________做氧化剂;若消耗了12gFeS2 有_______________mol电子发生了转移;
(3)C装置为净化装置,若无该装置,将混合气体直接通入D装置,除对设备有腐蚀外,还会造成的后果__________________________________________________ ___;
(4)如果D装置的温度是400℃~500℃,在常压下生成8gSO3,可放出的热量9.83kj,请写出该反应的热化学方程式________________________________________;并回答在工业中不采取加压措施的原因_ ____________________________。
[此题仅强化班做]21.已知 (注:R,R’为烃基),A为有机合成中间体,在一定条件下发生消去反应,可能得到两种互为同分异构体的产物,其中的一种B可用于制取合成树脂、染料等多种化工产品。A能发生如下图所示的变化。
(注:R,R’为烃基),A为有机合成中间体,在一定条件下发生消去反应,可能得到两种互为同分异构体的产物,其中的一种B可用于制取合成树脂、染料等多种化工产品。A能发生如下图所示的变化。
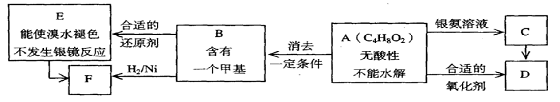
试回答:
(1)写出符合下述条件A的同分异构体结构简式(各任写一种):
a.具有酸性______________________b.能发生水解反应______________________
(2)A分子中的官能团是_____________,D的结构简式是_____________。
(3)C→D的反应类型是___________,E→F的反应类型是___________
a.氧化反应 b.还原反应 c.加成反应 d.取代反应
(4)写出化学方程式:A→B______________________ ______________________。
(5)写出E生成高聚物的化学方程式:_________________________________________。
(6)C的同分异构体Cl与C有相同官能团,两分子Cl脱去两分子水形成含有六元环的C2,写出C2的结构简式:_________________________ _____。
20.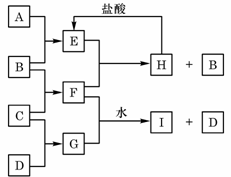 A、B、C、D是按原子序数由小到大排列的第二、三周期元素的单质。B、E均为组成空气的成分。F的焰色反应呈黄色。在G中,非金属元素与金属元素的原子个数比为1∶2。在一定条件下,各物质之间的相互转化关系如右(图中部分产物未列出):
A、B、C、D是按原子序数由小到大排列的第二、三周期元素的单质。B、E均为组成空气的成分。F的焰色反应呈黄色。在G中,非金属元素与金属元素的原子个数比为1∶2。在一定条件下,各物质之间的相互转化关系如右(图中部分产物未列出):
请填写下列空白:
(1)A是 ,C是 。
(2)H与盐酸反应生成E的化学方程式是 。
(3)E与F反应的化学方程式是 。
(4)F与G的水溶液反应生成I和D的离子方程式是 。
19.(1)称取等质量(均为ag)胆矾两份。把一份溶于bg水中,测知其溶解时吸收Q1kJ热量;把另一份脱水后溶于bg水中,测得其溶解时放热Q2kJ。从以上数据可知,胆矾脱水是______过程,1mol胆矾脱水需______kJ·mol-1热量。
过氧化氢是用途最广的过氧化物。试回答下列问题:
(2)过氧化氢是一种绿色氧化剂,写出在酸性条件下H2O2氧化氯化亚铁的离子反应方程式: 。
(3)Na2O2 、K2O2、 CaO2以及BaO2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,过滤即可制得。最适合的过氧化物是_(写电子式)
18.为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42- 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
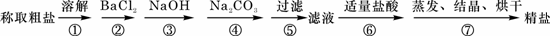
(1)判断BaCl2已过量的方法是______________________________________________。
(2)第④步中,相关的离子方程式是________________________________________。
(3)若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是__________________。
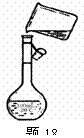 (4)为检验精盐纯度,需配制150 mL.0.2 mol/L NaCl(精盐)溶液,题26图是该同学转移溶液的示意图,图中的错误是____________ _____
(4)为检验精盐纯度,需配制150 mL.0.2 mol/L NaCl(精盐)溶液,题26图是该同学转移溶液的示意图,图中的错误是____________ _____
_________________________________________________________。
17.海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
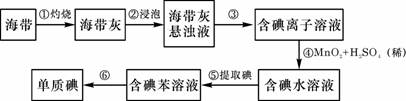
请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是 (从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是 ;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是 。
(3)步骤④反应的离子方程式是 。
(4)步骤⑤中,某学生选择用苯来提取碘的理由是 。
(5)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法: 。
15.t℃时,将100g某物质A的溶液蒸发掉10 g水,恢复至t℃,析出2.5g晶体。再蒸发掉10g水,恢复至t℃,析出7.5g晶体。下列说法中不正确的是
A.t℃时原100g溶液是饱和溶液
B.若析出的晶体中不含结晶水,则可计算出t℃时A的溶解度
C.若析出的晶体中含有结晶水且已知晶体的化学式和相关元素的相对元素原子质量,就可以计算出t℃时A的溶解度
D.根据题给条件可以计算出原溶液溶质的质量分数
[此题仅普通班做]16.为确定某溶液的离子组成,进行如下实验:
①.测定溶液的pH,溶液显强碱性。
②.取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体。
③.在上述②溶液中再滴加Ba(NO3)2溶液,产生白色沉淀。
④.取③ 中上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加Ag NO3溶液,产生白色沉淀。
根据实验以下推测正确的是[ ]
A.一定有SO32-离子 B.一定有CO32-离子
C.不能确定C1-离子是否存在 D.不能确定HCO3-离子是否存在
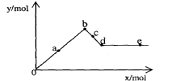 [此题仅强化班做]16.已知Ba(AlO2)2可溶于水。右图表示的是向A12(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加人Ba(OH)2的物质的量x的关系。下列有关叙述正确的是
[此题仅强化班做]16.已知Ba(AlO2)2可溶于水。右图表示的是向A12(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加人Ba(OH)2的物质的量x的关系。下列有关叙述正确的是
A.a-b时沉淀的物质的量:A1(OH)3比BaSO4多
B.c-d时溶液中离子的物质的量:AlO2-比Ba2+多
C.a-d时沉淀的物质的量:BaSO4可能小于A1(OH)3
D.d-e时溶液中离子的物质的量:Ba2+可能等于OH-
第二卷
14.向等体积的pH均为1的盐酸和醋酸溶液中分别滴加等物质的量浓度的氢氧化钠溶液,当滴至两溶液的pH相等时,盐酸中用去氢氧化钠溶液的体积为V1,醋酸中用去氢氧化钠溶液的体积为V2.判断V1 和V2的关系是
A.V1 =V2 B.V1>V2 C.V1 <V2 D.V1 ≤V2
13.室温下,在强酸性和强碱性溶液中都不能大量共存的离子组是
A.NH4+、Cu2+、Cl-、NO3- B.K+、Na+、SO32-、S2-
C.K+、Na+、AlO2-、SO42- D.Ba2+、Fe2+、NO3-、Br-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com