
6.下列有关溶液性质的叙述,正确的是 ( )
A.室温时饱和的二氧化碳水溶液,冷却到0℃时会放出一些二氧化碳气体
B.20℃,100g水可溶解34.2g KCl,此时KCl 饱和溶液的质量分数为34.2%
C.强电解质在水中溶解度一定大于弱电解质
D.相同温度下,把水面上的空气换成相同压力的纯氧,100g水中溶入氧气的质量增加
5.在恒温时,一固定容积的容器内发生如下反应:2NO2(g) N2O4(g)
达平衡时,再向容器内通入一定量的NO2(g),重新达到平衡后,与第一次平衡时相比,
NO2的体积分数 ( )
A.不变 B.增大 C.减小 D.无法判断
4.把Ba(OH)2溶液滴入明矾溶液中,使SO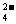 全部转化成BaSO4沉淀,此时铝元素的主要存
全部转化成BaSO4沉淀,此时铝元素的主要存
在形式是 ( )
A.Al3+ B.Al(OH)3 C.AlO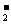 D.Al3+和Al(OH)3
D.Al3+和Al(OH)3
3.pH相同的盐酸和醋酸两种溶液中,它们的 ( )
A.H+的物质的量相同 B.物质的量浓度相同
C.H+的物质的量浓度不同 D.H+的物质的量浓度相同
2.上世纪80年代后期人们逐渐认识到,NO在人体内起着多方面的重要生理作用。下列关
于NO的说法不正确的是 ( )
A.NO分子中有极性共价键 B.NO是造成光化学烟雾的因素之一
C.NO是汽车尾气的有害成分之一 D.NO分子所含电子总数为偶数
1.下列各组物质中,互为同位素的是 ( )
A.重氢、超重氢 B.氧、臭氧
C.红磷、白磷 D.乙酸、丙酸
23、(14分)中和热的测定实验的关键是要比较准确地配制一定的物质的量浓度的溶液,量热器要尽量做到绝热;在量热的过程中要尽量避免热量的散失,要求比较准确地测量出反应前后溶液温度的变化。回答下列问题:
⑴中学化学实验中的中和热的测定所需的玻璃仪器有:________________,在大小烧杯之间填满碎泡沫(或纸条)其作用是__________________。结合日常生活的实际,该实验改在__________中进行效果会更好。
⑵该实验常用0.50mol/L HCl和0.55mol/L的NaOH溶液各50mL。NaOH的浓度大于HCl的浓度的作用是____________________。当室温低于10℃时进行对实验结果会造成较大的误,其原因是_________________________________________________。差
⑶若上述HCl和NaOH溶液的密度都近似为1g/cm3,中和_______kJ,△H=______kJ/mol(均填表达式)。
22、(8分)PbO2是很强的氧化剂,在酸性溶液中它可将Mn2+氧化成MnO4-。取一支试管,加入少量PbO2固体和2mL的6mol·L-1H2SO4,然后再加2mL的1mol·L-1MnSO4溶液,试回答: (1)搅拌后,溶液的颜色变化是______________________________; (2)写出反应的化学方程式并标出电子转移的方向和数目______________________; (3)能否用盐酸来代替硫酸___________(填能或不能),用化学方程式解释_______。
21、(8分)已知:在热力学标准态(298K、1.01×105Pa)下,由稳定的单质发生反应生成1mol化合物的反应热 叫该化合物的生成热(△H)。右图为氧族元素氢化物a、b、c、d的生成热数据示意图。试回答下列问题:
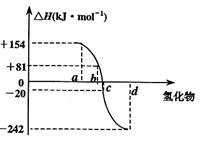
(1)写出氧族元素中含有18e-的两种氢化物的电子式 、 。
(2)请你归纳:非金属元素氢化物的稳定性与氢化物的反应热△H的关系 。
(3)写出硒化氢在热力学标准态下,发生分解反应的热化学反应方程式: 。
20、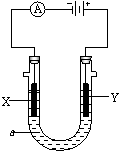 (16分)电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(16分)电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
⑴若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式是 。在X极附近观察到的现象是 。 ②Y电极上的电极反应式是 ,检验该电极反应产物的方法 。 ⑵如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则 ①X电极的材料是 ,电极反应式是 。 ②Y电极的材料是 ,电极反应式是 。 (说明:杂质发生的电极反应不必写出)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com