
26.(12分)
孔雀石和石青是自然界存在的两种碳酸盐类铜矿,它们的化学组成可表示为:
xCuCO3·yCu(OH)2(x、y为正整数且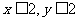 )
)
(1)孔雀石和石青分别与过量盐酸反应时,孔雀石耗用的盐酸的物质的量与生成的CO2的物质的量之比为4:1;石青则为3:1。请推算它们的化学组成。
孔雀石: ;石青: 。
(2)现有孔雀石和石青混合样品,取两份等质量的样品,在一份中加入过量盐酸,生成CO2
25.(8分)
维生素C(又名抗坏血酸,分子式为C6H8O6)具有较强的还原性,放置在空气中易被氧化,其含量可通过在弱酸性溶液中用已知溶液的I2溶液进行滴定。该反应的化学方程式如下:
C6H8O6+I2 C6H6O6+2HI
现欲测定某样品中维生素C的含量,具体的步骤及测得的数据如下。取10mL 6mol·L-1CH3COOH,加入100mL蒸馏水,将溶液加热煮沸后放置冷却。精确称取0.2000g样品,溶解于上述冷却的溶液中,加入1mL淀粉指示剂,立即用浓度为0.05000mol·L-1的I2溶液进行滴定,直至溶液中的蓝色持续不褪为止,共消耗21.00mLI2溶液。
(1)为何加入的CH3COOH稀溶液要先经煮沸、冷却后才能使用?
(2)计算样品中维生素C的质量分数。
24.(10分)
(1)具有支链的化合物A的分子式为C4H6O2,A可以使Br2的四氯化碳溶液褪色。1molA
和1mol NaHCO3能完全反应,则A的结构简式是 。
写出与A具有相同官能团的A的所有同分异构体的结构简式
。
(2)化合物B含有C、H、O三种元素,分子量为60,其中碳的质量分数为60%,氢的质量分数为13.33%。B在催化剂Cu的作用下被氧化成C,C能发生银镜反应,则B的结构简式是 。
(3)D在NaOH水溶液中加热反应,可生成A的钠盐和B,相应反应的化学方程式是
。
23.(8分)
根据下面的反应路线及所给信息填空。
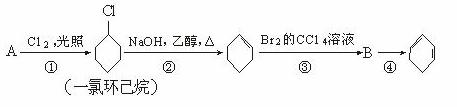
(1)A的结构简式是 ,名称是 。
(2)①的反应类型是 。
②的反应类型是 。
(3)反应④的化学方程式是
。
22.(10分)
我国研制的长征捆绑式火箭在第一、二级发动机中用“偏二甲(基)肼”和四氧化二氮作为液体燃料。
(1)已知偏二甲(基)肼的相对分子质量为60,其中含碳40%,含氢13.33%,其余为氮;
又知其分子中有一个氮原子不与氢原子相连。通过计算写出偏二甲(基)肼的化学式和
分子结构简式:
(2)在发动机中偏二甲(基)肼在四氧化二氮中充分燃烧,写出该燃烧反应的化学方程式
(反应中所有的氮元素均转化为N2)
21.(10分)
A是一种无色透明的晶体,进行如下实验
①取少量A晶体做焰色反应实验,透过蓝色钴玻璃观察,火焰呈紫色。
②取少量A晶体溶于水可以得到无色的溶液,该溶液使石蕊变红。
③取少量A的溶液加过量氨水,有白色沉淀B生成。
④过滤除去③中的B后,在滤液中滴加氯化钡溶液,有白色沉淀C生成,C不溶于稀硝酸。
⑤取少量B滴加氢氧化钠溶液,得无色溶液D。
⑥取少量B滴加盐酸,得无色溶液E。
⑦将47.4gA晶体在120℃下加热脱水,剩余物的质量为25.8g。
根据上述实验现象和结果确定A、B、C、D、E,写出它们的化学式。
A ________ B ________ C ________ D ________ E _________
20.(16分)
海水的综合利用可以制备金属镁,其流程如下图所示:
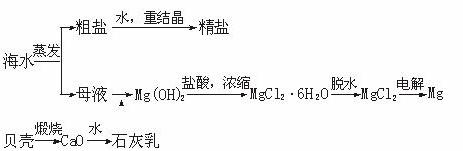
(1)若在空气中加热MgCl2·6H2O,生成的是Mg(OH)Cl或MgO,写出相应反应的化学方程式。
用电解法制取金属镁时,需要无水氯化镁。在干燥的HCl气流中加热MgCl2·6H2O时,能得到无水MgCl2,其原因是
。
(2)Mg(OH)2沉淀中混有的Ca(OH)2应怎样除去?写出实验步骤。
。
(3)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到
玻璃棒,分别说明在这三种情况下使用玻璃棒的目的;
溶解时: 。
过滤时: 。
蒸发时: 。
19.(4分)
用仪器A、B和胶管组成装置收集NO气体(①仪器A已经气密性检查;②除水外不能选用其他试剂)。
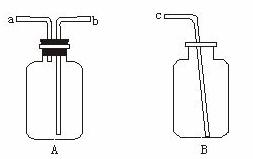
正确的操作步骤是:
18.右图曲线a表示放热反应X(g)+Y(g) Z(g)+M(g)+N(s)进行过程中X的转化率随时间 变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
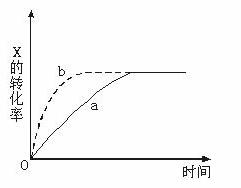 A.升高温度 B.加大X的投入量
A.升高温度 B.加大X的投入量
C.加催化剂 D.增大体积
第Ⅱ部分
17.强热硫酸亚铁固体可发生如下反应2FeSO4 Fe2O3 +SO2↓+SO3↑若将此反应生成的气体通入BaCl2溶液中,则 ( )
A.析出BaSO3沉淀 B.析出BaSO4沉淀
C.逸出SO3气体 D.逸出SO2气体
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com